미토콘드리아 DNA 고친다…첫 동물실험 성공- 동물 미토콘드리아 DNA 교정 성공해 미토콘드리아 질환 치료에 돌파구 마련
보도일 2021-02-19 19:00 연구단명유전체 교정 연구단






미토콘드리아 DNA 고친다…첫 동물실험 성공
- 동물 미토콘드리아 DNA 교정 성공해 미토콘드리아 질환 치료에 돌파구 마련 -
기초과학연구원(IBS, 원장 노도영) 유전체교정 연구단(단장 김진수)이 시토신 염기교정효소(DdCBE) DdCBE(DddA-derived cytosine base editor) : 세균의 독소에 유래된 DddA 탈아미노 효소를 두 조각으로 나누어 여기에 DNA에 염기 서열에 결합할 수 있는 TALE 단백질, 단백질을 미토콘드리아 내로 안내하는 서열(MTS : Mitochondrial Targeting Sequence), 우라실 글리코실레이즈 억제제(UGI : uracil glycosylase inhibitor)를 연결하여 만든 시토신 염기 교정 효소로, 2020년 7월 브로드 연구소 데이비드 리우 교수팀이 처음 학계에 보고하였다.
를 이용해 생쥐 미토콘드리아 DNA의 특정 염기를 바꾸는데 성공했다. DdCBE를 동물에 적용한 세계 최초의 사례로서, 치료가 어려웠던 미토콘드리아 질환 연구와 치료제 개발에 기여할 것으로 기대된다.
미토콘드리아는 에너지를 만들어내는 세포 내 소기관이다. 미토콘드리아 DNA에 변이가 일어날 경우 시력·청력 뿐 아니라 에너지가 많이 필요한 중추신경계·근육·심장 등에 치명적인 결함을 야기한다. 미토콘드리아 DNA는 모계 유전되기 때문에 모체의 미토콘드리아 DNA에 결함이 있을 경우 다음 세대로 고스란히 전달된다.
미토콘드리아 질환은 5,000명 중 한 명 꼴로 발생하는 비교적 흔한 유전질환이지만 아직까지 마땅한 치료법이 없다. 현재 유전체 교정 기술로 널리 활용되는 크리스퍼 유전자가위(CRISPR-Cas9) 크리스퍼 유전자가위(CRISPR-Cas9) : 가이드 RNA를 이용, Cas9 단백질이 교정할 목표 DNA를 인식할 수 있도록 한다. 이 방법은 세포 핵 속의 DNA에는 잘 작동하지만, 가이드 RNA가 미토콘드리아 막을 통과하지 못해 Cas9 단백질이 내부로 전달되지 않기 때문에 미토콘드리아 DNA 교정에는 적용할 수 없다.
로는 미토콘드리아 DNA 교정이 불가했다. 지난해 세균에서 유래한 DddA 탈아미노 효소가 DNA 이중 나선의 시토신(Cytosine) 염기를 티민(Thymine)으로 바꿀 수 있다는 사실이 밝혀 지면서 이를 활용한 새로운 염기교정효소인 DdCBE가 제작되었다. 이로써 미토콘드리아 DNA 교정은 가능해졌지만 이는 세포 수준의 연구로서, 질환 치료로 이어지기 위해서는 DdCBE가 동물 개체 수준에서도 정상 작동하는지 확인이 필요했다.
연구진은 우선 다양한 조합의 DdCBE를 생쥐 세포주 세포주(Cell Line) : 생체 밖에서 계속적으로 배양이 가능한 세포 집합
수준에서 선별하여 가장 효율이 높은 DdCBE를 선정하였다. 최적의 조건에서 DdCBE를 생쥐 배아에 미세주입하여 미토콘드리아 DNA에 작용시킴으로써 시토신 염기를 티민으로 치환하는 데 성공했다. 정확하고 효과적인 방식으로 미토콘드리아 DNA 서열이 변환된 동물을 최초 제작한 것이다.
나아가 어미 생쥐의 교정된 미토콘드리아 DNA 서열이 다음 세대에게도 온전히 전달됨을 확인했다. DdCBE가 동물 개체 수준에서 정상 작동함을 최초로 확인한 것이다.
연구를 주도한 이현지, 이성현 선임연구원은 “미토콘드리아 DNA를 동물배아 수준에서 정밀하게 교정할 수 있게 됐다”며 “향후 미토콘드리아 질환 기작 연구와 치료제 개발에 새 길을 열 것으로 기대한다”고 전했다.
이번 연구결과는 오픈액세스 학술지인 네이쳐 커뮤니케이션즈 (Nature Communications, IF 11.878) 2월 19일 19시(한국시간) 온라인 판에 게재되었다.
[붙임] 1. 연구내용 2. 그림 설명 3. 연구진 이력사항
연구 추가 설명
논문명
/저널명
Mitochondrial DNA editing in mice with DddA-TALE fusion deaminases / Nature communications
저자정보
Hyunji Lee*, Seonghyun Lee*, Gayoung Baek, Annie Kim, Beum-Chang Kang, Huiyun Seo and Jin-Soo Kim
연구내용
보충설명
미국 브로드 연구소의 데이비드 리우(David Liu) 교수 연구진은 2020년 7월 세균 효소에서 유래한 시토신 염기교정효소‘DdCBE’로 미토콘드리아 DNA를 편집할 수 있음을 학계에 보고하였다. IBS 연구진은 2021년 2월 DdCBE를 동물 개체에 적용하는데 최초로 성공했다.
미토콘드리아 내 DNA에 돌연변이가 생길 경우 세포의 에너지 대사에 문제가 생겨 중추신경계 이상을 유발하는 등 매우 치명적인 결함을 초래한다. 그러나 미토콘드리아 내 전달 가능한 유전자가위가 거의 없었기 때문에 미토콘드리아 질환에 대한 동물모델을 제작할 수 없을 뿐 아니라 치료에 있어 적용이 매우 제한적이었다.
IBS 연구진은 DdCBE를 동물 배아에 전달, 미토콘드리아 DNA가 교정된 동물 개체를 선보였다. 미토콘드리아 유전질환 치료를 위한 형질전환 실험동물 제작에 크게 기여할 것으로 기대한다.
연구 이야기
[연구 배경]
지난 해 DdCBE가 학계에 보고되었다. 그러나 이는 세포 수준의 연구로서, 실제 임상 적용과 치료제 개발로 이어지기 위해서는 동물개체에 적용이 필요했다. 연구진은 DdCBE를 이용한 미토콘드리아 DNA 교정 모델 동물을 제작하여 미토콘드리아 유전질환 연구와 치료제 개발에 기여하고자 연구에 착수했다.
[어려웠던 점]
DdCBE를 동물에 적용하는 첫 사례이기 때문에 생쥐배아에 최적화된 조건을 찾는 것이 어려웠다. 교정 결과를 분석하려면 DdCBE를 생쥐배아에 미세주입하여 대리모에 이식한 후 자손을 얻기까지 20일 가량을 기다려야한다. 이 시간을 단축하기 위하여 먼저 동물 세포주와 배아의 배반포 단계에서 교정을 확인하는 방법으로 최적화된 DdCBE 조건을 찾았다. 가장 효율이 높은 DdCBE를 미세주입한 후 대리모에 이식하여 최종적으로 미토콘드리아 DNA가 교정된 생쥐를 얻을 수 있었다.
[주목할 점]
DdCBE를 동물 개체 수준에 적용하여 최초로 미토콘드리아 DNA 서열이 변환된 동물을 선보였다. 앞으로 DdCBE를 이용하여 미토콘드리아 질환과 관련한 다양한 형질전환 동물을 효과적이고 정확하게 만들 수 있는 방법을 제시한다. 특히 미토콘드리아 유전질환의 원인이 되는 미토콘드리아 DNA 돌연변이를 배아수준에서 정밀하게 교정할 수 있는 가능성을 보여줬다는 점에서 의의를 찾을 수 있다.
[향후 연구계획]
미토콘드리아 DNA 교정 효율을 높일 수 있는 방법을 연구하고 다양한 미토콘드리아 유전질환 동물 모델을 만들어 질환의 기작 연구 및 치료제 개발에 기여하고자 한다.
그 림 설 명
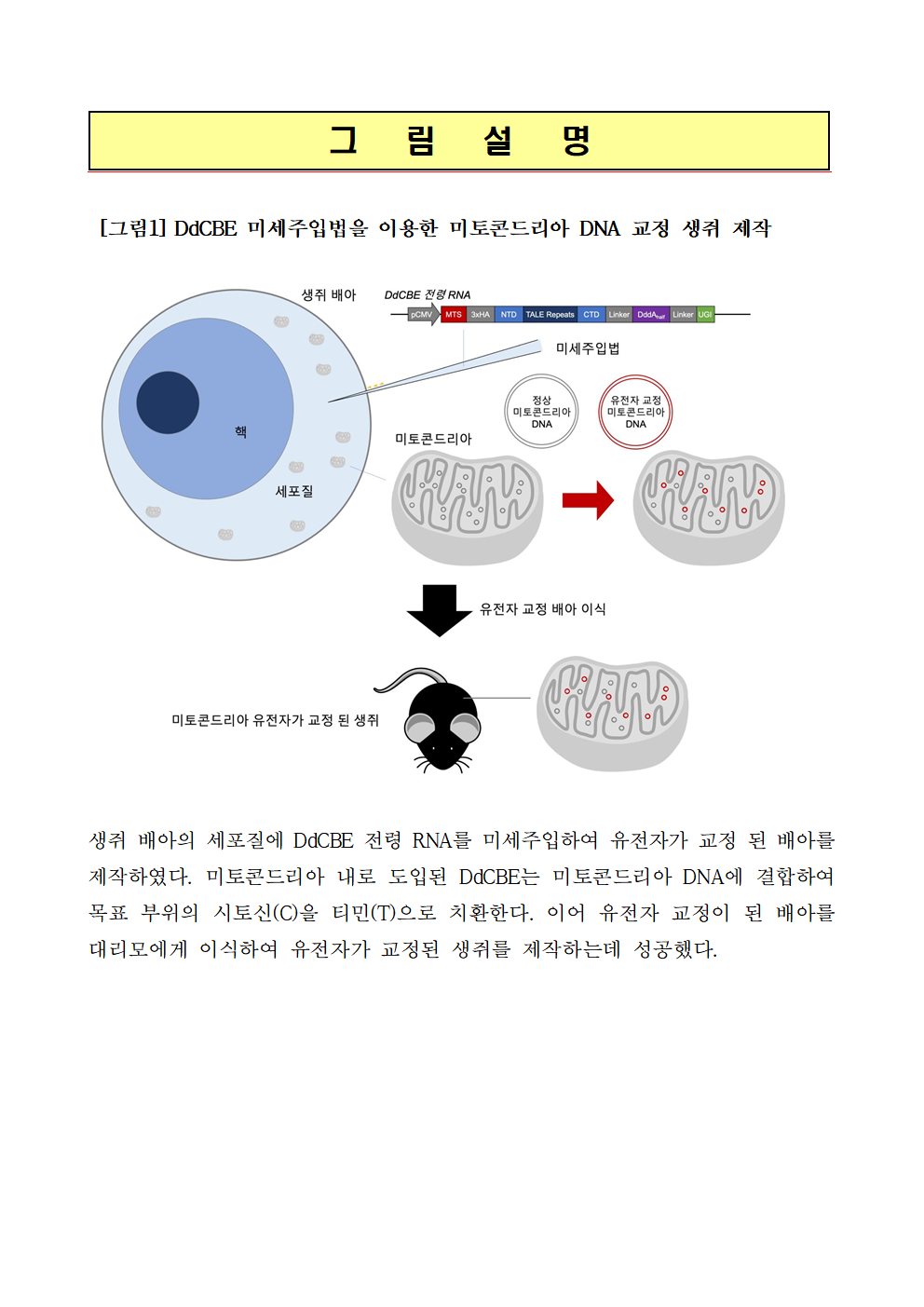
[그림1] DdCBE 미세주입법을 이용한 미토콘드리아 DNA 교정 생쥐 제작
생쥐 배아의 세포질에 DdCBE 전령 RNA를 미세주입하여 유전자가 교정 된 배아를 제작하였다. 미토콘드리아 내로 도입된 DdCBE는 미토콘드리아 DNA에 결합하여 목표 부위의 시토신(C)을 티민(T)으로 치환한다. 이어 유전자 교정이 된 배아를 대리모에게 이식하여 유전자가 교정된 생쥐를 제작하는데 성공했다.
[그림2] DdCBE를 이용한 미토콘드리아 DNA 교정 생쥐 제작
세포의 에너지 대사에 관여하는 ND5라는 미토콘드리아 DNA에 DdCBE를 이용하여 시토신(C)을 티민(T)으로 교정하였다. 그 결과 ND5에 종결코돈이 만들어진 미토콘드리아 DNA 교정 생쥐가 태어났다.
[그림3] DdCBE에 의해 교정된 미토콘드리아 DNA의 자손세대 전달
DdCBE에 의해 교정된 생쥐를 정상 생쥐와 교배하여 자손을 얻었고, 자손(101)의 다양한 조직에서 교정된 미토콘드리아 DNA 교정 결과가 잘 전달되었음을 확인하였다.
연구진 이력사항
<김진수 IBS 유전체 교정 연구단 연구단장, 교신저자>
1. 인적사항
○ 소 속 : 기초과학연구원(IBS) 유전체 교정 연구단
서울대학교 화학부
2. 경력사항
○ 1994 – 1997 : 美 MIT/Howard Hughes Medical Institute, Associate
○ 1997 – 1999 : 삼성생명과학연구소 연구책임자
○ 1999 – 2005 : (주)툴젠 대표이사/연구소장
○ 2005 – 현재 : 서울대학교 화학부 조교수/부교수/정교수/겸임교수
○ 2010 – 2014 : 미래부․연구재단 지정 창의연구단장
○ 2014 – 현재 : 기초과학연구원(IBS) 연구단장
3. 수상실적
○ 아산의학상, 아산재단 (2017)
○ 홍진기 창조인상, 유민문화재단 (2017)
○ 올해의 과학자상, 한국과학기자협회 (2015)
○ 서울대 자연과학대학 연구상 (2010)
○ 교육과학기술부/과학재단 이달의 과학자상 (2004)
<이현지 선임연구원, 공동 제1저자>
1. 인적사항
○ 소 속 : IBS 유전체 교정 연구단 선임연구원
2. 경력사항
○ 2016 – 2016 : 이화여자대학교, 박사후연구원
○ 2017 – 2020 : 기초과학연구원(IBS) 유전체 교정 연구단, 연구위원
○ 2020 – 현재 : 기초과학연구원(IBS) 유전체 교정 연구단, 선임연구원
3. 수상실적
○ 이화여자대학교 우수학위논문상 (2016)
<이성현 선임연구원, 공동 제1저자>
1. 인적사항
○ 소 속 : IBS 유전체 교정 연구단 선임연구원
2. 경력사항
○ 2020 - 2020 : 기초과학연구원(IBS) 유전체 교정 연구단, 연구위원
○ 2020 - 현재 : 기초과학연구원(IBS) 유전체 교정 연구단, 선임연구원
3. 수상실적
○ 서강대학교 화학과 우수논문상 (2016, 2017, 2018, 2019)
○ 한국 단백질-생물리화학 연합학회 젊은과학자상 (2017)
○ 한국 바이오칩학회 Springer 우수 논문 발표 상 (2019)
'판교핫뉴스1' 카테고리의 다른 글
| 인간처럼 인지적 촉감 느끼는 촉감 아바타 기술 개발-개인별 감성 복제 촉감 아바타 기술 실마리 (0) | 2021.02.20 |
|---|---|
| 새로운 뇌종양 면역반응 규명-뇌종양세포의 산소소비 막아 주변 선천성 면역세포 활성화 (0) | 2021.02.20 |
| [제7주차 IR52 장영실상] 삼성전자 / 엑시노스 9110 FO-PLP 통합 칩 패키지 (0) | 2021.02.20 |
| 경기도-한국인터넷진흥원-한국인터넷광고재단, 온라인 플랫폼 광고 분쟁 해소를 위한 업무 협약 체결 (0) | 2021.02.20 |
| 경기도, 인공지능(AI) 정책자문단 발족…인공지능 정책 발굴 본격화 (0) | 2021.02.20 |
