생명연, 난치성 위암의 새로운 치료 해법 찾았다-불포화지방산 합성경로에 따른 새로운 세포사멸경로 조절기전 원리 규명
작성자 : 관리자작성일 : 2021-01-13














생명연, 난치성 위암의 새로운 치료 해법 찾았다
- 불포화지방산 합성경로에 따른 새로운 세포사멸경로 조절기전 원리 규명
- 향후 난치암 치료제 개발에 큰 기여를 할 것으로 기대
□ 국내연구진이 ‘페롭토시스’라는 새로운 세포사멸 기전을 이용한 난치성 위암의 효과적인 치료방안을 제시하고, 이에 대한 원인을 규명하였다. 향후 페롭토시스를 이용한 난치암 치료제 개발에 큰 기여를 할 것으로 기대된다.
※ 페롭토시스(Ferroptosis) : 세포막의 지질과산화로 인해 유도되는 철-의존적인 괴사성 세포사멸이다. 정상적인 세포 내에서는 지질 알코올로 환원되는 경로를 통해 독성을 완화시키는 것으로 알려져 있다.
ㅇ 한국생명공학연구원(원장 김장성, 이하 생명연) 대사제어연구센터 이상철/이은우 박사팀, 한국기초과학지원연구원 황금숙 박사팀, 연세대학교 의과대학 허용민 교수팀(교신저자:이상철/이은우/황금숙/허용민, 제1저자: 이지윤/남미소/손혜영)이 공동으로 수행한 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오·의료기술개발사업 및 한국생명공학연구원과 한국기초과학지원연구원의 기관주요사업의 지원으로 수행되었고, 세계적 저널인 미국립과학원 회보 ‘PNAS’ 2020년 12월 7일자 온라인 판에 게재되었다.
(논문명 : Polyunsaturated fatty acid biosynthesis pathway determines ferroptosis sensitivity in gastric cancer)
□ 위암(Gastric cancer)은 세계적인 암 사망의 주요 원인이며(매년 100만명 이상 암 발병 판정), 국내 암 사망자수에서도 3위에 올라와 있다. 현재 조기진단이나 수술 기술이 발달함에 따라 생존율은 높아지고 있지만, 아직 진행성 위암의 경우 효과적인 치료제가 없는 상황이다.
ㅇ 이러한 치료제 개발의 실패의 주요 원인은, 진행성 위암 중 중간엽(mesenchymal)세포의 특성을 지니는 암은 쉽게 전이가 되거나 기존 항암제에 내성을 지니며 재발하기 때문이다. 따라서, 중간엽형에 해당하는 환자들은 5년 생존률이 30% 미만으로 나타나는, 가장 예후가 나쁜 환자군으로 보고된 바 있다.
※ 중간엽 세포 : 수정란이 분열하여 생긴 중배엽에서 분화된 줄기세포의 한 종류로서 자기 복제 및 다양한 세포로의 분화가 가능함
ㅇ 현재 재발이나 전이된 위암을 치료하기 위한 다양한 연구가 활발히 진행되고 있지만 많은 부분이 아직까지 밝혀지지 않았다.
□ 페롭토시스(Ferroptosis)는 세포막의 지질과산화에 의해 발생하는 철(Ferrous)-의존적 세포사멸 경로이며, 최근 항암제 내성암을 비롯한 다양한 난치암의 효과적인 세포사멸 경로로서 주목받고 있다.
※ 지질과산화(Lipid peroxidation) : 세포를 구성하는 세포막은 다양한 지질로 구성이 되어있으며, 지질과산화는 세포막에 불균형을 유발하며 세포사멸로 이끄는 원인이 될 수 있다. 특히 지질을 구성하는 불포화지방산은 활성산소에 의해 쉽게 과산화가 된다.
※ 철-의존적 세포사멸 : 철분을 조효소로 사용하여 활성산소 생성을 유도하는 세포사멸 경로
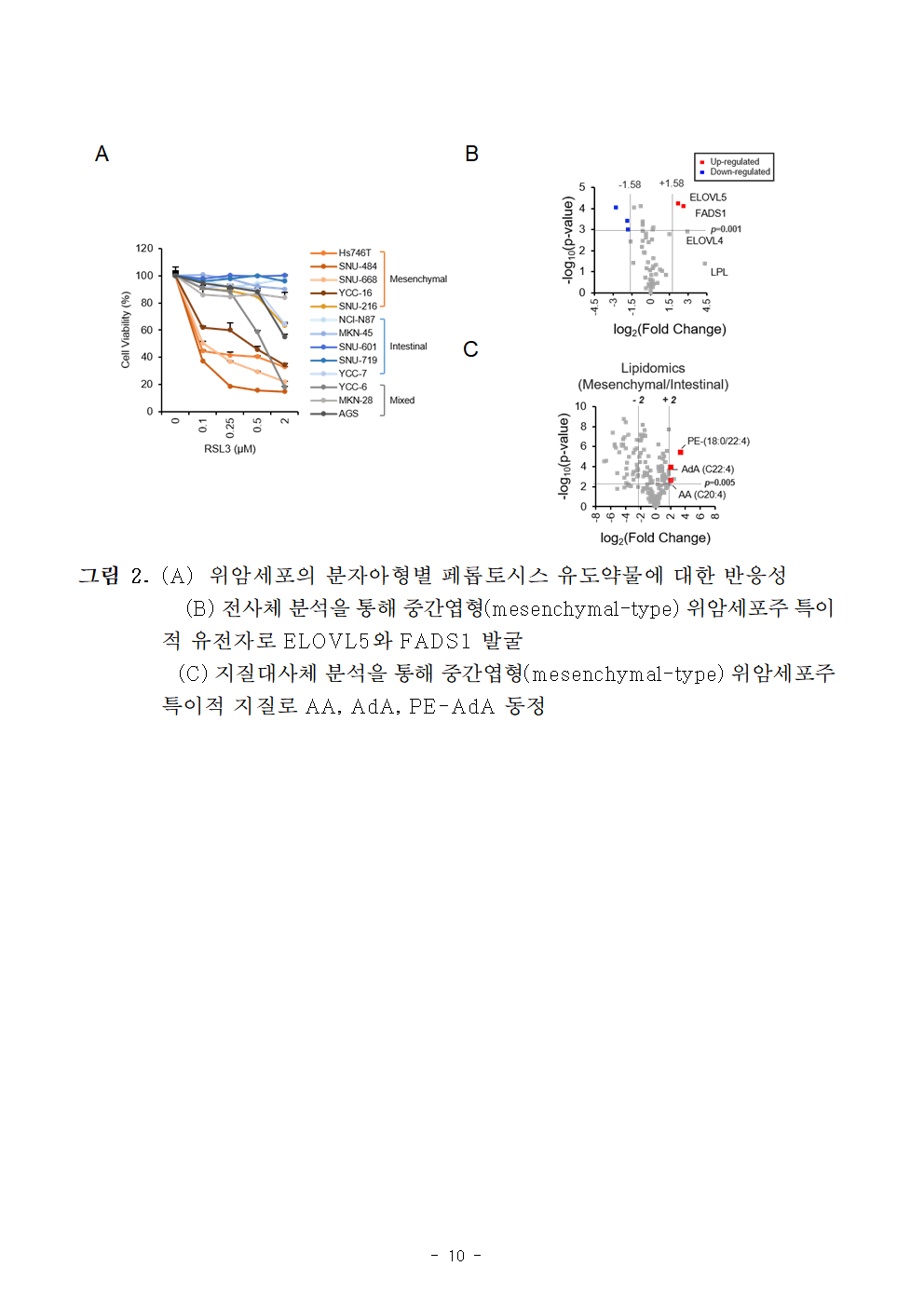
ㅇ 본 연구팀은 위암 환자의 전사체 정보를 기반으로 위암세포주들을 중간엽형(mesenchymal-type)과 상피형(epithelial-type)으로 분류 했을 때, 중간엽형 위암세포만이 페롭토시스 약물에 의해 죽는 것을 확인하였다.
ㅇ 이는 본 연구에서 발굴한 신규 유전자(ELOVL5, FADS1)가 중간엽형 위암세포주에서 페롭토시스 진행의 핵심 인지질 형성에 필수적이며, 지질과산화가 쉽게 일어날 수 있는 환경을 조성하여 위암세포를 잘 죽게 만들 수 있음을 규명한 것이다.
□ 공동연구책임자인 허용민 교수는 “동 연구성과를 통해 향후 개발될 난치병 치료제는 위암 중에서도 기존의 표준 항암제로는 재발을 방지할 수 없는 난치성 위암에 효과가 있을 것으로 기대되며, 대사 신약 개발의 모델이 될 수 있을 것”이라고 덧붙였다.
□ 공동연구책임자인 이은우 박사는 “페롭토시스라는 새로운 세포사멸기전에서 불포화지방산 합성경로의 중요성을 밝힌 것”이라며, “새로이 발굴된 유전자(ELOVL5와 FADS1)가 항암제 반응성을 예측하는 중요한 단서가 될 수 있을 것”이라고 덧붙였다.
□ 공동연구책임자인 황금숙 박사는 “본 연구성과에서 불포화 지방산 합성경로 규명에 활용된 지질체학 및 대사추적 신기술은 앞으로 난치성 질환의 새로운 치료 타겟 발굴에 핵심적인 역할을 할 것이다.“고 밝혔다.
연 구 결 과 개 요
□ 연구배경
○ 위암(Gastric cancer)은 세계적인 암 사망의 주요 원인으로 매년 100만명 이상이 암 발병 판정을 받고 있으며, 국내 암 사망자수에서도 3위에 올라와 있다. 현재 수술 등 치료법이 발달함에 따라 생존율은 높아지고 있지만 5년이내 재발률이 80-90%이상으로 5년 생존율이 50%대로 낮은 편에 속하며, 재발이나 전이된 암의 경우 수술과 항암치료를 병행하고 있지만 아직까지 효과적인 치료제가 없는 상황이다.
○ 상피간엽이행(EMT, epithelial to mesenchymal transition)은 상피세포성 암이 중간엽세포 특성을 지닌 종양세포로 변형되는 것으로, 치료제 내성이나 암 전이를 유도하는 것으로 보고되고 있다.
○ 페롭토시스는 세포막의 지질과산화에 의해 유도되는 철-의존적인 세포사멸 경로이다. 정상적인 세포 내에서는 글루타티온(GSH) 과산화효소인 Glutathione Peroxidase 4 (GPX4)에 의해 과산화지질이 무독성 지질 알코올로 환원되어 세포의 생존을 유지하는 것으로 알려져 있다. 또한, 다양한 불포화지방산 중에서 특히 포스파티틸에탄올아민(Phosphatidylethanolamine; PE)에 결합된 아라키돈산(AA)과 아드렌산(AdA)에서 과산화가 많이 발생되며, 세포사멸을 유도하는 것으로 알려져 있다.
□ 연구내용
○ 연구팀은 중간엽형(mesenchymal-type)위암세포가 페롭토시스 유도 약물에 민감하게 반응하여 잘 죽는 반면, 상피형(epithelial-type) 위암세포는 죽지 않는 것을 확인하고, 이들 세포들의 전사체 분석를 통해 중간엽형 세포에서 공통적으로 높은 발현을 보이는 다중불포화지방산 합성에 관여하는 두 유전자(ELOVL5, FADS1)를 발굴하였다.
○ 지질대사체(Lipidome) 분석을 통해, 중간엽형 세포들은 페롭토시스에 중요한 인지질인 PE-AA와 PE-AdA를 과량 함유하고 있는 것을 확인하였다.
○ 또한, 지질추적분석(Lipid tracing analysis)을 통해, 중간엽형 세포들은 필수지방산인 리놀렌산(Linoleic acid)으로부터 아라키돈산(AA) 및 아드렌산(AdA)을 합성하는 능력이 뛰어난 반면, 상피형 세포들은 전혀 합성하지 못하는 것을 확인하였다.
○ ELOVL5, FADS1의 역할을 규명하기 위해 CRISPR-Cas9 시스템을 이용하여 유전자 녹아웃(KO)을 진행하였고, 유전자가 결손된 위암세포주는 지방산 및 지질합성이 저하됨과 페롭토시스 유도 약물에 저항성을 보임을 확인하였다.
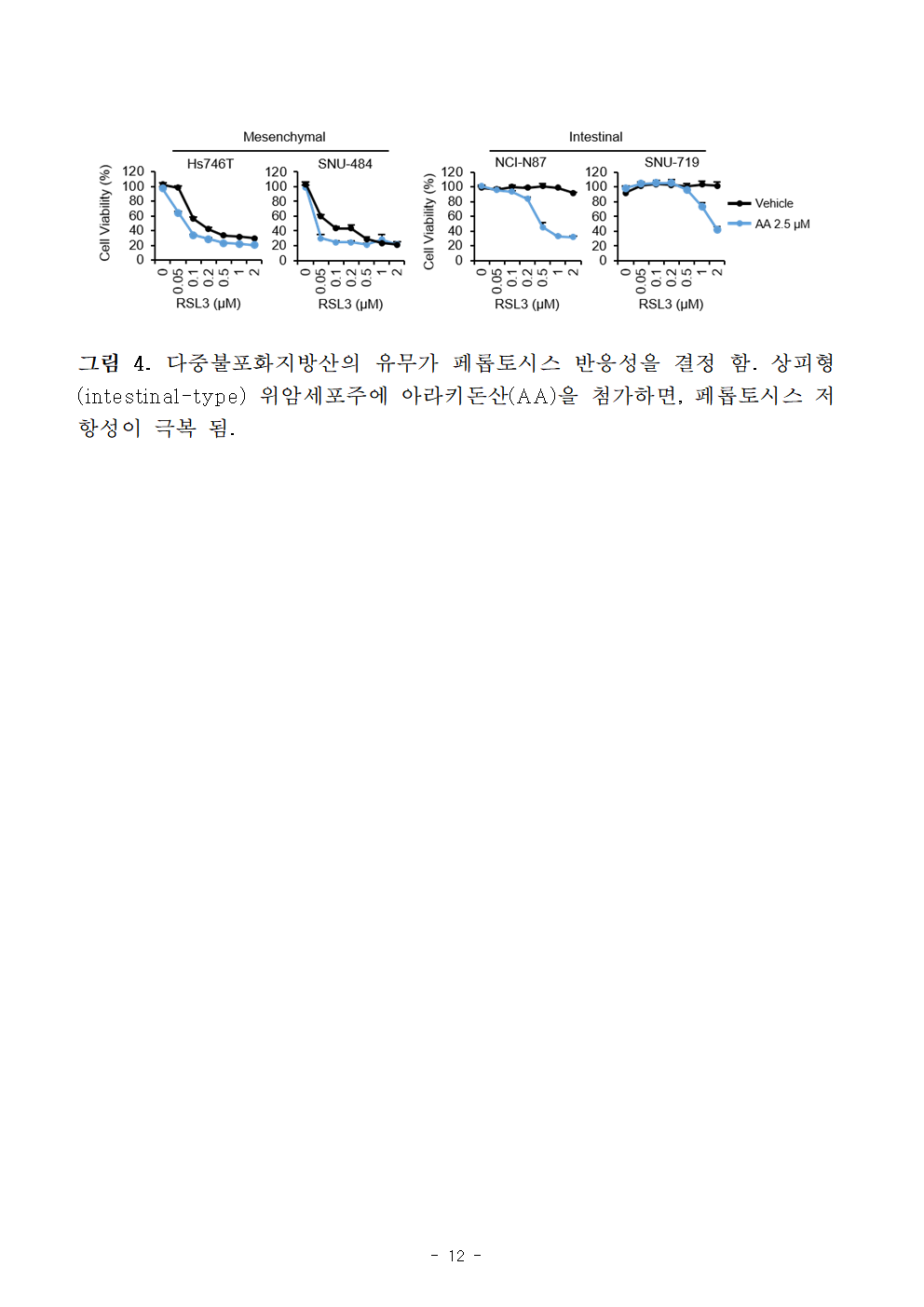
○ 반대로 ELOVL5, FADS1 두 유전자 발현이 낮은 상피형 위암세포주에 아라키돈산을 유입시키게 되면 페롭토시스 유도 약물에 민감하게 반응함을 확인하였다.
○ 이를 통해 다중불포화지방산 합성효소인 ELOVL5, FADS1이 지방산 합성을 통해 최종적으로 페롭토시스 반응성을 결정하는 주요 인자임을 밝혔다.
○ 마지막으로, 중간엽형 위암세포주들에서는 ELOVL5와 FADS1의 프로모터 부위에 메틸화가 없는 반면, 상피형 위암세포주에서는 많이 발견됨을 확인하였고, 따라서 두 유전자의 발현이 DNA메틸화에 의해 조절됨을 확인하였다.
○ 이를 통해, 향후 ELOVL5, FADS1의 항암제 내성 위암 진단 마커 또는 페롭토시스의 반응성 마커로서의 활용 가능성을 살펴볼 수 있었다.
□ 연구성과의 의미
▶ : ELOVL5, FADS1의 페롭토시스 세포사멸 조절 규명
○ ELOVL5와 FADS1이 리놀렌산으로부터 아라키돈산과 아드렌산을 합성하며, 페롭토시스 세포사멸 핵심지질인 포스파티딜아민 생성을 촉진하며 암세포의 사멸을 유도한다는 결과는 페롭토시스의 새로운 핵심조절인자를 밝힌 것으로 학문적으로 가치가 뛰어나다.
▶ 신규 타겟으로서의 ELOVL5, FADS1의 가치 검증 및 활용 방안 제시
○ ELOVL5와 FADS1이 페롭토시스 조절에 중요하다는 근거를 제시하고, 위암의 분자아형별 발현의 차이가 페롭토시스 반응성 차이를 결정한다는 연구 결과는, 향후 페롭토시스를 통한 항암제의 반응성 예측에 ELOVL5, FADS1의 발현이 중요할 것이라는 것을 제시한다.
○ 또한, 페롭토시스는 다양한 허혈성 질환(심근경색, 뇌질환 등)과 대사질환(비알콜성지방간염, 동맥경화) 등의 발생 및 진행에 핵심적인 역할을 하기 때문에, 불포화지방산 합성경로와 페롭토시스 조절을 통해 이들 질환의 치료제 개발에도 큰 기여를 할 것으로 기대된다.
* ELOVL5 (Elongation of very long-chain fatty acid protein 5) : 다중불포화지방산 합성경로에서 지방산의 길이를 연장하는 기능을 함
* FADS1 (Fatty acid desaturase 1) : 다중불포화지방산 합성경로에서 지방산에 이중결합을 추가하여 불포화시키는 기능을 함
* PE (Phosphatidylethanolamine): 세포막에 존재하는 인지질의 한 형태. 주로 두 개의 지방산 체인과 결합하여 세포막에 존재함.
* AA (Arachidonic acid, C20:4n-6) : ω-6 계열의 다중불포화지방산으로 FADS1 효소에 의해 디호모감마리놀렌산(DGLA)으로부터 합성됨
* AdA (Adrenic acid, C22:4n-6) : ω-6 계열의 다중불포화지방산으로 ELOVL5 효소에 의해 아라키돈산(AA)으로부터 합성됨
연 구 결 과 문 답
이번 성과 뭐가 다른가
1. 항암제 내성을 지니는 중간엽형 위암세포의 특이 유전자로 ELOVL5과 FADS1을 발굴
2. 이 두 유전자의 발현이 페롭토시스라는 최근 발견된 세포사멸에 진행에 핵심역할을 함을 규명
어디에 쓸 수 있나
1. 페롭토시스 유도제는 차세대 항암제로서 다양한 시도가 되고 있는데, 본 연구에서 발견한 두 유전자의 발현이 페롭토시스의 반응성을 예측하는 마커로 사용될 수 있음
2. 두 유전자의 발현을 제어함으로써, 심근경색, 뇌질환, 동맥경화 등 다양한 질환의 치료기술 개발에 사용 가능
실용화까지 필요한 시간은
본 연구결과는 암 치료의 새로운 개념과 치료표적을 제시하는 기초연구로서, 치료제 후보물질 발굴 및 임상 단계의 시도와 속도에 따라 실용화 소요시간이 결정될 것
실용화를 위한 과제는
다양한 페롭토시스 유도제들이 개발되었지만, 아직 임상에 진입한 약물은 없는 상황임. 따라서, 새로운 약물 개발 및 다중화를 통해 임상에 사용할 수 있는 약물 개발이 시급함. 또한, 페롭토시스 내성 기전에 대한 기초연구를 통해, 페롭토시스를 극대화 할 수 있는 병용약물의 개발이 필요함.
연구를 시작한 계기는
페롭토시스라는 세포사멸은 2012년에 처음 소개된 만큼, 잘 알려지지 않은 세포사멸 경로이지만 2017년에 항암제 내성암에 효과적이라는 Nature 논문의 발표 이후 이를 이용한 항암치료법 개발이 전 세계적으로 진행되고 있음. 본 연구진도 마침 2017년 연세대 의과대학과 항암제 내성암 치료전략에 대한 공동연구를 기획 중에 있었는데, 본 논문을 참고하여 페롭토시스를 적용하기로 전략을 바꾸게 되었음.
에피소드가 있다면
ELOVL5 단백질을 검출하기 위해 western blot 분석을 했을 때, 단백질이 원래 크기보다 매우 큰 형태로 나타났었고, 다양한 실험을 통해 ELOVL5 단백질이라는 것을 증명했음에도 불구하고, 이를 리뷰어가 끝까지 문제 삼는 바람에 게재 승인을 받지 못할 까 걱정했었다. 그러나, 이 단백질을 샘플을 끓이면 단백질이 응집되어서 나타하는 현상임을 두 번째 리비전 과정 중에서 뒤늦게 발견하고 나서야, 논문이 간단히 마무리 되었다.
꼭 이루고 싶은 목표는
페롭토시스를 이용하여 암 뿐만 아니라 관련 허혈성질환, 대사질환들의 치료제 개발에 기여하고 싶음
신진연구자를 위한 한마디
본 연구는 연세대 의과대학의 유전체 정보와 한국기초과학지원연구원의 지질대사체 분석을 통해 얻어진 결과 임. 또한 KAIST에서 녹아웃 세포제작을 지원해 주었고, 많은 분들의 조언을 통해 좋은 결과를 얻을 수 있었음. 주변의 좋은 공동연구자들을 만나는 것이 연구를 즐겁게 효율적으로 할 수 있는 것 같음
용 어 설 명
1. 페롭토시스(Ferroptosis)
◦ 세포막의 지질과산화로 인해 유도되는 철-의존적인 괴사성 세포사멸이다. 정상적인 세포 내에서는 글루타티온 과산화효소인 GPX4에 의해 지질 알코올로 환원되는 경로를 통해 독성을 완화시키는 것으로 알려져 있다.
2. 지질과산화(Lipid peroxidation)
◦ 세포를 구성하는 세포막은 다양한 지질로 구성이 되어있으며, 지질과산화는 세포막에 불균형을 유발하며 세포사멸로 이끄는 원인이 될 수 있다. 특히 지질을 구성하는 불포화지방산은 활성산소에 의해 쉽게 과산화가 되며, 포스파티딜아민을 구성하는 아라키돈산과 아드렌산에서 과산화가 많이 발견되고 있다.
3. 글루타티온 과산화효소 (GPX4, Glutathione peroxidase 4)
◦ 활성화 자리에 셀레노시스테인(selenocysteine)잔기를 지진 셀레늄단백질(selenoprotein)로, 동물세포에 총 8개의 이성질체를 가지고 있다. 그중 GPX4만이 지질과산화를 환원시킬 수 있다고 알려져 있다.
4. 다중불포화지방산 생합성경로 (Polyunsaturated fatty acid biosynthesis pathway)
◦ ω-6 불포화지방산은 필수지방산으로 외부에 유입되어 세포 내에서 생합성경로를 통해 다양한 지질을 합성되며, 다양한 지방산 신장효소(Elongases)와 불포화효소(Desaturases)가 생합성에 관여한다. 다중불포화지방산은 세포막의 구성 성분으로 사용될 뿐만 아니라, 이후 대사과정을 거처 다양한 신호전달 및 염증 관련 물질로 사용된다.
그 림 설 명
그림 1. 다중불포화지방산 합성경로 및 지질과산과에 의한 페롭토시스 세포 사멸 기작.
(오른쪽) 기존에 알려진 조절인자. 아라키돈산(AA)과 아드렌산(AdA)은 지질합성 효소(ACSL4, LPCAT3)에 의해 세포막에 존재하며, 지질과산화효소(PEBP1, LOXs)에 의해 과산화되어 축적됨에 따라 세포막을 파괴하고, 세포사멸에 이르게 됨
(왼쪽) 신규 조절인자. 아라키돈산(AA)과 아드렌산(AdA)은 다중불포화지방산 합성효소(ELOVL5, FADS1)를 통해 세포 내에서 합성이 되며, 이 효소의 발현 여부에 따라 세포사멸 반응성이 결정 됨
A B
C
그림 2. (A) 위암세포의 분자아형별 페롭토시스 유도약물에 대한 반응성
(B) 전사체 분석을 통해 중간엽형(mesenchymal-type) 위암세포주 특이적 유전자로 ELOVL5와 FADS1 발굴
(C) 지질대사체 분석을 통해 중간엽형(mesenchymal-type) 위암세포주 특이적 지질로 AA, AdA, PE-AdA 동정
A B
그림 3. ELOVL5 또는 FADS1 유전자는 페롭토시스에 필수적인 역할을 함 (A) ELOVL5 또는 FADS1 유전자가 결손된 중간엽형 위암세포에서 페롭토시스 저항성 증가
(B) ELOVL5 또는 FADS1 유전자가 결손된 중간엽형 위암세포는 페롭토시스 관련 지질을 적게 함유함
그림 4. 다중불포화지방산의 유무가 페롭토시스 반응성을 결정 함. 상피형(intestinal-type) 위암세포주에 아라키돈산(AA)을 첨가하면, 페롭토시스 저항성이 극복 됨.
이상철 박사 이력사항
1. 인적사항
o 소 속 : 한국생명공학연구원
대사제어연구센터
2. 경력사항
o 1985 - 현재 한국생명공학연구원 책임연구원
o 2013 - 2015 한국연구재단 국책연구본부장
o 2010 - 2012 한국연구재단 국책연구본부 생명공학단장
o 2006 - 2009 한국생명공학연구원 연구정책부장
o 2005 - 2020 과학기술연합대학원대학교(UST) 교수
o 1997 - 1998 California Institute of Technology, Research associate
3. 전문 분야 정보
o 생화학, 단백체학
이은우 박사 이력사항
1. 인적사항
o 소 속 : 한국생명공학연구원
대사제어연구센터
2. 경력사항
o 2011 - 2016 연세대학교 박사후연구원
o 2016 - 현재 한국생명공학연구원 선임연구원
3. 전문 분야 정보
o 세포사멸(Apoptosis, Necroptosis, Ferroptosis), 유비퀴틴화(Ubiquitination)
황금숙 박사 이력사항
1. 인적사항
o 소 속 : 한국기초과학지원연구원
서울서부센터
2. 경력사항
o 2005 - 현재 한국기초과학지원연구원 책임연구원
o 2009 - 현재 충남대학교 분석과학기술대학원 학연교수
o 2015 - 현재 이화여자대학교 나노화학과 겸임교수
o 2014 - 2019 한국기초과학지원연구원 서울서부센터장
o 2000 - 2005 Harvard Medical School, Research Fellow
o 1996 - 1999 삼성연구소, 선임연구원
3. 전문 분야 정보
o 분석생화학, 대사체학, 구조생물학
허용민 교수 이력사항
1. 인적사항
o 소 속 : 연세대학교 의과대학
영상의학교실
2. 경력사항
o 2005 – 2009 연세대학교 의과대학 영상의학교실 조교수
o 2007– 2009 UT MD Anderson Cancer Center, Visiting Assistant Proffesor
o 2009 – 2014 연세대학교 의과대학 영상의학교실 부교수
o 2014 – 현재 연세대학교 의과대학 영상의학교실 정교수
o 2015 – 2018 연세대학교 에비슨특훈교수
o 2015 – 현재 연세대학교 의과대학 부설연구소 연의생공연메디컬융합
연구소 소장
3. 전문 분야 정보
o 분자진단 및 유전체 연구(Molecular Diagnosis and Genome Research), 자기공명영상 및 조영제 연구(Nanomedical Imaging), 분자 및 세포 영상(Molecular and Cellular Imaging)
