제10차 혁신성장 BIG3 추진회의 개최
2021.05.26.
- (21-10) 04 (보도자료) 제10차 혁신성장 BIG3 추진회의 개최 3.hwp 75.0 KB다운로드다운로드 아이콘 자료열기자료 바로 열기 아이콘
- (21-10) 04 (보도자료) 제10차 혁신성장 BIG3 추진회의 개최 3.pdf 373.5 KB다운로드다운로드 아이콘 자료열기자료 바로 열기 아이콘
- (21-10) 02 BIG3 산업별 중점추진과제 5 (공개).hwp 1.26 MB다운로드다운로드 아이콘 자료열기자료 바로 열기 아이콘
- (21-10) 03 바이오산업 지식재산 정책지원 추진방안_최종(공개).hwp 373.5 KB다운로드다운로드 아이콘 자료열기자료 바로 열기 아이콘





















































「제10차 혁신성장 BIG3 추진회의」개최
□ 홍남기 부총리 겸 기획재정부장관은 ‘21.5.26(수) 09:30서울대병원 의학연구혁신센터(서울 종로구)를 찾아 현장점검과 함께 제10차 혁신성장 BIG3 추진회의를 개최하였음
ㅇ 이는 BIG3 산업 분야별로 현장점검을 겸한 집중논의를 위한 세번째 방문행사임
* 첫번째 방문: 미래차 현장(서울 상암 자율차 시범지구, 4.16일(금))* 두번째 방문: 시스템반도체 현장(판교 시스템반도체 설계지원센터, 5.6일(목))
< 서울대병원 현장방문 개요 >
▪일 시:5.6(목) 09:30~10:00
▪장 소:종로 서울대병원 의학연구혁신센터
▪참 석:(정부) 홍남기 부총리, 임혜숙 과기정통부 장관, 권칠승 중기부 장관,박진규 산업부 차관, 강도태 복지부 제2차관, 김용래 특허청장
(민간위원) 묵현상 국가신약개발사업단장, 김재섭 에이프로젠 대표이사김법민 범부처 전주기 의료기기 연구개발 사업단장
(바이오헬스 산업현장) 김연수 서울대학병원장, 이효근 SD바이오센서 대표이사
▪내 용:
➀ 서울대병원 신약·의료기기 개발·지원 현황점검
➁ 입주·창업기업 방문
□ 서울대병원 의학연구혁신센터는 병원내 연구 이외에도 산합연 융합연구, 의료기기 사용적합성 평가지원, 바이오헬스 분야 창업기업 지원 등을 수행
ㅇ 홍남기 부총리를 비롯한, BIG3 추진회의 위원, 바이오헬스 산업현장 참석자들은 신약·의료기기 개발 및 창업기업 등 지원현황을 점검하고 개발중인 재활보조 로봇을 시연
ㅇ 그리고 코로나19, 패혈증 등 진단키트, 지주막하출혈 치료용 신약 등을 개발하는 창업기업 등을 방문하여 연구·생산시설을 둘러보고 기업대표 및 임직원을 격려
□ 이어서 10:00 홍남기 부총리는 「제10차 혁신성장 BIG3추진회의」를 주재하였음
ㅇ 금번 회의에는 묵현상 국가신약개발사업단장, 김재섭 에이프로젠 대표이사, 김법민 범부처 전주기 의료기기 연구개발 사업단장, 김연수 서울대학병원장, 이효근 SD바이오센서 대표이사 등 바이오헬스 관련 전문가 등이 참석하였으며,
ㅇ ① BIG3 산업동향 및 분야별 정책추진 상황② BIG3 산업별 중점 추진과제 ②-1 포스트 코로나 의료기기 산업육성을 위한 전략
②-2 미래 정밀의료 선도를 위한 바이오 빅데이터 구축·활용계획 ②-3 생물안전연구시설(BL3) 운영 활성화 및 규제개선
③ 바이오산업 지식재산 정책지원 추진방안안건이 논의되었음
※ (붙임) 1. 부총리 모두 발언2. 각 부처별 담당자 및 연락처
※ (별첨) 1. BIG3 산업 중점추진과제
1-1 포스트 코로나 의료기기 산업육성을 위한 전략1-2 미래 정밀의료 선도를 위한 바이오 빅데이터 구축·활용계획1-3 생물안전연구시설(BL3) 운영 활성화 및 규제개선
2. 바이오산업 지식재산 정책지원 추진방안
붙임 1
부총리 모두 발언
□ 지금부터 제10차 혁신성장 BIG3 추진회의를 현장에서 시작하겠음
ㅇ 바쁘신 가운데 현장점검을 겸한 오늘 회의에 참석해 주신묵현상 국가신약개발 사업단장님, 김재섭 에이프로젠 대표이사님, 김법민 범부처 전주기의료기기 연구개발사업단장님 3분 민간위원님께 감사
ㅇ 특히 오늘 특별히 참석해 주신 김연수 서울대학교병원장님, 이효근 SD바이오센서 대표님 등 바이오헬스 현장에 계신 2분께도 감사
□ 최근 바이오산업은 고령화, 자원고갈, 기후변화 등 글로벌 사회문제 해결을 위한 돌파구이자 지속가능한 성장을 위한 ‘신성장동력’으로 각광받고 있음
☞ 비유/비교로 말씀드리자면 반도체가 한 세대를 먹여 살린 산업이었다면 바이오는 ‘또 다른 한 세대를 먹여 살릴 미래산업’이 아닐 수 없음
□ 특히 오늘 회의에서 주로 논의할 레드바이오 분야, 즉 바이오헬스산업은 코로나19 판데믹, 인구문제 및 건강관심 등이 맞물리며 최근 ‘폭풍성장’ 상황
ㅇ 즉 바이오헬스 수출은 ‘20년부터 40~50%대의 높은 증가세를 보이고 있고 매출액 1조원을 초과하는 제약‧바이오기업도 ’18년 6개에서 ‘20년 12개로 2배 증가하였으며 코스피‧코스닥 시가총액 상위 10대기업중 바이오기업이 다수 포진할 만큼 우리 경제의 주력산업으로 성장
* 바이오헬스 수출(억불, %): (‘18) 81(13.3) → (’19) 91(12.3) → (‘20) 139(52.7) → (’21.1~4) 51(40.9)
ㅇ 아울러 모더나‧아스트라제네카 등 주요 코로나 백신을 위탁생산하는 등 우리나라가 세계의 백신허브로 부상하고 있으며 동시에 백신자주권 확보를 위한 국내 백신개발 등에도 박차
□ 다만 이번 코로나 백신개발‧보급 등에서도 보았듯이 바이오헬스산업은 기술선도자의 승자독식(winner takes all) 가능성이 높으므로 “기술경쟁, 시간싸움, 총력지원”이 매우 중요
☞ 정부는 급변하는 바이오산업 환경에 대응, 신약‧혁신의료기기 등 핵심기술에 대한 R&D 집중투자, 사업화 지원, 임상 인프라 확충, 전문인력 육성 등 전방위적으로 지원해 나갈 것
☞ 이러한 맥락에서 오늘 이곳 “서울대병원 의학연구혁신센터 현장”에서 바이오헬스산업 집중육성을 위한 정책과제 및 현안들을 집중 점검코자 함
이와 함께 글로벌 백신허브 도약기반 구축을 위한 방안도 마련중에 있는 바, 조만간 발표해 드릴 예정
<금일 혁신성장 BIG3 추진회의 주요 논의>
□ 오늘 회의에서는 BIG3산업중 바이오헬스 관련안건만 집중 상정 논의함
먼저 ①-1포스트 코로나 의료기기산업 육성전략①-2미래 정밀의료 선도를 위한 바이오 빅데이터 구축·활용 계획①-3생물안전연구시설(BL3) 운영 활성화 및 규제개선안 등 3건과
두 번째 ②바이오산업 지식재산정책 지원 추진방안을 상정·논의함
? 첫 번째 안건은 「포스트 코로나 의료기기산업 육성전략」임
ㅇ 고령화 등에 따라 국내 의료기기산업은 빠르게 성장하고 있으나, 사용경험 및 인지도 부족 등으로 시장진출에 한계 → ‘25년까지 세계시장 점유율 10→7위 달성을 위해 국내 의료기기 전략분야 집중육성, 산업생태계 조성 등 추진
① 먼저 국내의료기기 사용 활성화를 위해 병원부설 교육훈련센터 2개(‘20)에 이어 광역형센터 2개(수도권1, 비수도권1)를 추가 구축하고, 디지털헬스 테스트베드 운영과 함께 혁신의료기기 사용 의료기술은 건보체계에 신속 포함
② 아울러 체외진단, 치과·영상진단 등 주력분야에 대해 범부처 전주기 R&D를 추진하고 해외진출 지원을 위해 의료기기 국제인증지원센터를 구축(‘22~, 1개소)
③ 한편 신의료기술평가 맞춤형 컨설팅 실시, 신속 시장출시를 위한 허가·심사 특례개선은 물론 의료기기산업 종합지원센터를 애로해소 허브로 활용
? 두 번째 안건 「미래 정밀의료 선도를 위한 바이오 빅데이터 구축·활용계획」임
ㅇ 데이터 기반 정밀의료*가 바이오헬스 미래를 주도할 것이라 전망되면서미·영·중 등은 바이오 빅데이터 구축·활용을 위한 대규모 투자 추진중
→ 우리도 미래정밀의료 분야 글로벌 5대 선도국가(TOP 5)로 도약하기 위해
’23년부터 6년간 약 1조원을 투입하는 “100만명 바이오 빅데이터 구축**” 추진
* “정밀의료”란 유전체·임상·생활정보 등을 토대로 환자에게 맞춤의료(예방·진단·치료)를 제공
** 시범사업(‘20~, 410억원)에 이어 총 6년간 9,878억원의 본사업 추진예정으로 상반기 중 예타추진 예정
① 먼저 질환별 환자 40만명, 자발적 참여자 60만명 등 100만명 바이오 빅데이터를 수집하는 소위 “국가통합 바이오데이터댐”을 2028년까지 100% 구축
(고품질 유전체 데이터 생산+데이터 추적환류체계 마련)
② 아울러 민감정보인 바이오 빅데이터의 원활하고 안전한 활용 등을 위해 빅데이터 표준화 및 품질관리를 위한 표준작업절차(SOP) 수립, 플랫폼(H/W) 구축, 슈퍼 컴퓨팅기반 보안 분석환경 구축 등을 추진
③ 한편 임상, 역학, 멀티오믹스 등 데이터 기반 연구과제 지원 및 비지니스 모델 개발과 유전체 분석 핵심기술·장비 개발(’23~) 등 산업화 과제를 적극 지원해 나갈 것
? 세 번째 안건은 「생물안전연구시설(BL3) 운영 활성화 및 규제개선」으로 감염병에 대한 필수 연구시설인 생물안전 3등급 연구시설(BL3)의 개방성∙접근성 강화 및 공급 확대를 위해 마련
① 바이러스기초연구소 보유시설 등을 개방형으로 시범운영하는 등 기존시설 활용을 극대화하고 동식물 감염병 연구용 BL3 시설을 국내 최초로 구축(‘22~) 검토
② 부처·기관별로 산재한 BL3 공동활용을 위해 one-stop 지원시스템을 구축하고, 시설∙자원 공유를 위해 BL3를 보유한 연구소, 대학 등이 참여하는 연구인프라 협의체도 구성 운영 → 개방형 시설 활용시 BL3 미보유 기관의 감염병 연구 허용, 실험승인 심사기간 단축(60→30日) 등 연구자원 취급규제도 개선
? 마지막 안건은 「바이오산업 지식재산 정책지원 추진방안」임
바이오산업은 소수의 특허로 시장독점이 가능하는 등 특허가치가 타 산업에 비해 높은 만큼 개발단계부터 특허분쟁 대응, 지식재산 데이터 활용지원 등 바이오헬스시장을 선점할 수 있도록 체계적으로 지원하는 것이 중요
ㅇ (지식재산데이터활용·보호) 특허생물자원 통합정보DB(바이오 지식재산 데이터댐)를 ’22년까지 구축하여 실시간 제공하고 하반기중 의료‧방역 물품을 특허출원 우선심사 대상에 포함하여 심사기간 약 12개월(14.1→2.1개월) 단축 추진
ㅇ (지식재산 보호·분쟁 대응) 특허·영업비밀 보호를 위해 기술침해·인력탈취 조사·수사 전담체계를 구축하고, ‘21년까지 「부정경쟁방지·영업비밀보호 5개년 계획」 수립 및 「산업재산권 정보 분석·활용 촉진법」 제정도 추진할 것임
(모두발언 여기까지임)
붙임 2
각 부처별 담당자 및 연락처
◇ 세부내용에 대한 문의사항이 있는 경우, 아래 각 부처별 담당자에게 문의하여 주시기 바랍니다.
혁신성장 BIG3 추진회의
21-10(공개)
BIG3 산업(바이오헬스)중점 추진과제
2021. 5. 26.
관 계 부 처 합 동
순 서
Ⅰ. 포스트 코로나의료기기 산업 육성을 위한 전략 1
Ⅱ. 미래 정밀의료 선도를 위한바이오 빅데이터 구축·활용계획 14
Ⅲ. 생물안전연구시설(BL3)운영 활성화 및 규제개선 30
포스트 코로나
의료기기산업 육성을 위한 전략
□ (글로벌 환경) 의료기기 산업의 지속 성장 및 경쟁의 격화
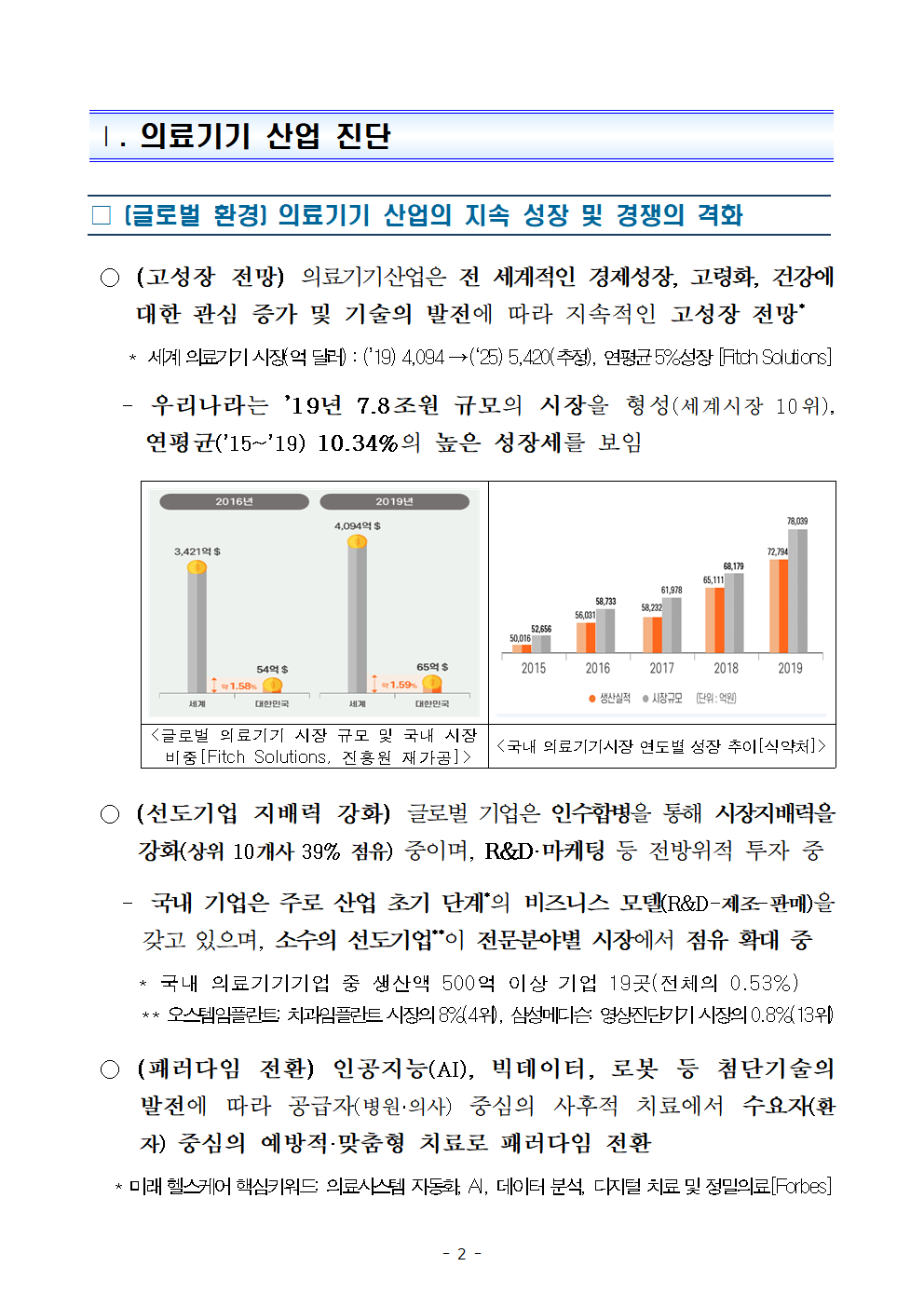
○ (고성장 전망) 의료기기산업은 전 세계적인 경제성장, 고령화, 건강에 대한 관심 증가 및 기술의 발전에 따라 지속적인 고성장 전망*
* 세계 의료기기 시장(억 달러) : (’19) 4,094 → (‘25) 5,420(추정), 연평균 5%성장 [Fitch Solutions]
- 우리나라는 ’19년 7.8조원 규모의 시장을 형성(세계시장 10위), 연평균(’15~’19) 10.34%의 높은 성장세를 보임
<글로벌 의료기기 시장 규모 및 국내 시장 비중[Fitch Solutions, 진흥원 재가공]>
<국내 의료기기시장 연도별 성장 추이[식약처]>
○ (선도기업 지배력 강화) 글로벌 기업은 인수합병을 통해 시장지배력을 강화(상위 10개사 39% 점유) 중이며, R&D·마케팅 등 전방위적 투자 중
- 국내 기업은 주로 산업 초기 단계*의 비즈니스 모델(R&D-제조-판매)을 갖고 있으며, 소수의 선도기업**이 전문분야별 시장에서 점유 확대 중
* 국내 의료기기기업 중 생산액 500억 이상 기업 19곳(전체의 0.53%)
** 오스템임플란트: 치과임플란트 시장의 8%(4위), 삼성메디슨: 영상진단기기 시장의 0.8%(13위)
○ (패러다임 전환) 인공지능(AI), 빅데이터, 로봇 등 첨단기술의 발전에 따라 공급자(병원·의사) 중심의 사후적 치료에서 수요자(환자) 중심의 예방적·맞춤형 치료로 패러다임 전환
* 미래 헬스케어 핵심키워드: 의료시스템 자동화, AI, 데이터 분석, 디지털 치료 및 정밀의료[Forbes]
□ (국내 현황) 산업 초기단계의 영세성, 내수시장 활성화부터 필요
○ (기술수준) 우리나라 의료기기 산업 기술력은 최고기술국(미국) 대비 79.5% 수준, 약 3.5년의 기술격차가 있는 것으로 평가
* 美(100%) > EU(95.1%) > 日(87.1%) > 韓(79.5%) > 中(76.5%) [한국보건산업진흥원]
- 중소‧영세기업(생산액 10억 미만)이 전체 기업의 54.1%, 연구‧임상‧인허가‧마케팅 등 제품 개발 및 판매를 위한 역량 부족
○ (내수시장) 수입의존도(62%)가 높고*, 우수 국산제품이 있으나 사용경험 및 인지도 부족, 건강보험 미적용 등으로 국내 의료기관에서 사용 저조**
- 건강보험은 기존 치료기술보다 치료효과의 현저한 개선을 입증해야만 혁신성을 인정하고 있어, 영세한 국내기업에는 높은 장벽
* 국내 의료기기 시장규모 : (’15년) 5.3조원(수입 63.3%) → (’19년) 7.8조원(수입 62.1%)[식약처]
** 서울대병원 의료진 287명 중 44%는 국산 데모제품 사용경험 없으며, 초음파영상진단장치는 의료기기 중 수출 1위 품목임에도 상급종합병원 내 국산사용비율 21.1%에 불과
○ (인큐베이팅 필요) R&D-임상시험-마케팅-해외진출까지 산업 전반이 아직 걸음마 단계로, 일정수준 도달까지 전략적·집중적 육성이 필요
- 디지털 헬스케어, 체외진단 등 새로운 기술과 융합한 영역은 아직 글로벌 지배기업이 없어 우리 기술력을 활용한 시장선도 가능*
< 우리기업의 글로벌 시장 선도 사례>
* (루닛社) 인공지능 X-ray 판독으로 세계 100대 AI 기업 선정(’17)
* (씨젠社) Real-time PCR 기술(TOCE, DPO) 개발(‘11), 코로나19 확산에 따라 분자진단 시약 조기 출시로 시장선점
⇒ 시약개발 자동화, 제품 다변화(변이진단, 동시진단, 타액진단)를 통해 국내외 시장 선도, 2020년 매출 1조원 달성
⇒ 포스트 코로나 시대의 국제경쟁력 강화를 위한 의료기기산업의 국내 발전기반 조성 및 체계적·전략적 육성계획 마련 필요
Ⅱ. 비전 및 추진전략(안)
비전
포스트 코로나, 의료기기산업을 신성장 동력으로 육성
정책 목표
►국산 의료기기 내수시장 점유율 향상 및 선도형 기업 육성
* 상급종합병원 내 국산의료기기 점유율 : (‘20) 10%→ (’23) 12% → (‘25) 14%
* 매출액 500억원 이상 혁신형 의료기기기업 : (‘20) 7개 → (‘23) 10개 → (’25) 14개
►국내 의료기기를 수출 주력 품목으로 육성
* 수출액(억 달러) : (‘20) 57→ (’23) 65 → (‘25) 71
* 글로벌 시장 점유(세계순위) : (‘20) 10위→ (’23) 9위 → (‘25) 7위
국산
의료기기
사용 활성화
전략① 사용경험 확대 및 보상체계 마련
사용자 경험환경 조성
임상 근거 축적 지원
기술가치 보상을 통한 시장진입 촉진
전략분야
집중육성
전략② 글로벌 경쟁력이 있는 전략 품목에 대한 지원 강화
체외진단 의료기기 경쟁력 강화
주력분야 기술 고도화
해외진출 역량 강화
산업
생태계 조성
전략③ 혁신성장을 위한 정책적 지원
정책지원 강화
산업규제 합리화
통합 정보제공
체계 구축
Ⅲ. 주요전략 및 실행계획(안)
전략①
사용경험 확대 및 보상체계 마련
◈ 국산 의료기기 사용경험을 축적할 수 있도록 지원하고 기술 가치에 대한 보상체계 마련을 통해 국산 의료기기 구매로 연계
진 단
추진방향(~‘25)
국산 의료기기 사용경험 저조
병원, 트레이닝 센터 등을 통한
경험 환경 조성
임상 유효성 입증 등 근거축적에 한계
혁신의료기기 실증지원센터 등을 통해 근거축적 지원 및 연구 활성화
건강보험제도 내에서 혁신기술에 대한 가치보상 제한
테스트베드 운영을 통해 점진적으로 혁신 가치 보상체계 마련
❶ 사용자 경험환경 조성
○ (트레이닝K 플랫폼 구축) 국내 의료진의 국산 의료기기 사용 경험 축적을 위해 ①병원형, ②광역형 트레이닝 센터 구축
- (병원형 부설센터 운영) 인지도 높은 대학병원 내 센터*를 운영, ‘사용-피드백-개선’을 경험토록 하여 국산 제품 구매로 연계
* 국산의료기기 교육훈련센터 지정·운영 중(’20∼’24, 세브란스·아산병원, 연간 각 8억 지원)
- (광역형 센터 구축) 접근성 제약 등 병원 부설센터의 한계를 보완하기 위해 광역형 통합센터* 구축 추진(’22~, 수도권·비수도권 각 1개소, 신규)
* (주요기능) 의학회 연계 단체교육 실시, 공동 교육 프로그램 운영, 의료기기 상설전시 등
<글로벌 기업의 국내트레이닝 센터 구축・운영 사례>
대학병원 내
진료과별 센터 위탁운영
‧ (인튜이티브서지컬) 세브란스병원, 아산병원, 서울성모병원 등에 다빈치 수술로봇센터 구축
‧ (메드트로닉) 서울대병원을 트레이닝 센터로 지정하여, 약물 주입 펌프 삽입술 훈련
‧ (필립스) 서울대병원을 디지털 플랫폼 활용 심혈관 중재시술 트레이닝 센터로 지정
대규모 센터 별도 구축
‧ 올림푸스 트레이닝 센터(송도, 370억원)
‧ 메드트로닉 이노베이션 센터(오송, 230억원)
‧ 인튜이티브서지컬 수술혁신센터(상암, 100억원)
→ 의학회 연계 프로그램 운영, 국내기업 이용불가
○ (구매연계) 트레이닝K 플랫폼 등을 통해 우수성을 검증한 제품에 대해 국・공립 의료기관 선도구매 활성화* 추진(’21~, 조달청)
* 트레이닝 성과를 혁신성 평가와 연계하여 혁신시제품 확대, 수의계약, 시범구매 등
○ (의료기기 국산화·디자인 개선) ①기술수준은 높지 않으나 수입의존도가 높은 의료기기 국산화 지원* 및 ②사용자 친화적 디자인 개선 지원* 추진(’22~, 신규)
* (치료재료) 창상피복재, 내시경 투관침, 카테터, (의료장비) 수술용 복강경, 후두경 등
○ (병원-기업 공동 기술개발) 의료진이 의료기기 개발에 참여하는 병원 주관의 기술개발을 통해 사업화 모델 마련(’22~, 산업부)
❷ 임상근거 축적 지원
○ (임상효과 실증) 혁신의료기기 실증지원센터*를 활용하여 제품 개발 전주기에 걸친 다양한 임상시험 실시 및 실사용 데이터 축적
* 서울대·세브란스 등 5개 컨소시엄(12개 의료기관) 지정 운영 중(’20∼’22, 연 90억원)
○ (해외연구·임상시험 지원) 혁신형 기업 제품의 해외진출을 위해 외국 기업·기관과의 공동연구 및 해외 임상연구 지원 추진(‘22~, 신규)
○ (국산 의료기기 실증검증) 국산 디지털 헬스 의료기기를 활용한 개인 맞춤형 건강관리 모델을 구축, 국산의료기기 성능 실증 검증
- 지자체, 지역의료기관 등과 공동으로 취약계층 등 개인의 건강정보를 국산의료기기를 통해 모니터링하는 시범사업 추진(’22~, 신규)
< 국산 의료기기 실증 검증 사업 모형(예시) >
❸ 기술가치 보상을 통한 시장진입 촉진
○ (디지털 헬스 수가 마련 지원) AI활용 소프트웨어(영상진단・병리), 디지털치료제, 전자약 등 혁신의료기기를 의료기관(공모)에 보급하고 실증 및 사용 데이터 축적 유도
- 실증에 따른 보상(국비) 시범사업(’22~’26, 신규)을 추진하여, 향후 건강보험 급여 제도화 등을 위한 근거로 활용
< 혁신기술 보상 중장기 로드맵(안) >
단 계
내 용
목 표
1단계(’22)
AI활용 SW 제품 테스트베드 구축
다기관 시범보급 및 실증 데이터 축적
2단계(’23~’24)
테스트베드 대상 품목 확대 및 디지털헬스 수가 시범 적용
효과적 임상근거 성과 창출 본격화
3단계(’25~)
디지털헬스 수가* 보상 체계 마련
혁신제품 시장진입 활성화
* 소프트웨어 의료기기 특성에 적합한 등재방식, 가치보상방법 등 건강보험 급여화 방안 검토
○ (혁신의료기술 신속한 시장진입 지원) 혁신기술의 가치가 신속하게 건강보험 급여화로 이어져 의료현장에 사용·확산될 수 있는 방안 마련
- 혁신의료기기를 사용하는 의료기술은 ‘혁신의료기술’로 인정, 별도 신의료기술평가 없이 일정기간 건강보험 체계에 신속하게 포함* 추진
* 유사한 기존 수가 준용하여 선별급여 적용 또는 한시적 비급여 등재 등
- 이를 위해 혁신의료기기 지정절차에 복지부·식약처·NECA·심평원·진흥원의 참여를 제도화하여 지정부터 수가 연계까지 ONE-STOP 절차 검토
○ (투자·금융) 의료기기 산업 활성화를 위한 펀드 조성 또는 기존에 운영중인 펀드* 투자 확대, 정책금융 지원 등 검토(‘22~)
* K-바이오 신성장 펀드 6호, 스마트 대한민국 펀드, 한국판 뉴딜펀드, 소부장 펀드 등
○ (세제혜택) 의료기기산업 투자촉진을 위한 조세 혜택 및 투자 인센티브 지원 방안 마련 연구(‘21~)
전략②
글로벌 경쟁력이 있는 전략 품목에 대한 지원 강화
◈ 코로나19를 계기로 성장한 체외진단 의료기기 분야 및 기술경쟁력이 있는 기존 의료기기 분야를 전략 육성하고 해외진출 지원
진단
추진방향(~‘25)
체외진단 의료기기
코로나19 계기
국내외 시장 급성장
소재 국산화와 혁신제품 개발을 통해 글로벌 경쟁력 강화
영상진단 등 주력분야
치과‧영상진단 등 주력제품 글로벌 경쟁력 강화 필요
주력제품의 기술력 고도화 및 수입의존도가 높은 분야 국산화
해외진출 지원
해외 인증이 강화되었으나 국내기업 대응력 부재
인증획득 및 글로벌 판로 개척을 지원
❶ 체외진단 의료기기 경쟁력 강화
○ (제품개발 지원) 코로나19 이후 폭발적 수출 증가 추세를 보이고 있는 체외진단기기(‘19년 약 4억달러 →‘20년 약 30억 달러)의 진단장비‧소재 국산화 및 혁신제품 개발지원*
* R2R 전자동 대량신속 저비용 진단 플랫폼 개발, 분자진단키트 시약용 원재료 및 양산기술 개발(’20∼, 범부처), 시료전처리 일체형 LAMP 분자진단기기 개발(’20∼’22, 복지부) 등
○ (임상평가 네트워크 구축) 기업-의료기관 간 매칭*을 통해 진단키트 등의 검체 대상 성능평가를 지원하고 검체보유 현황 등 정보 포털 구축(’20~, 20억원)
* 기업별 평가기관 및 연구자 매칭, 임상평가 계획 검토, 유효성 평가 전문가 코칭, (‘20) 코로나19 검체(혈액, 호흡기 등) → (’21∼) 코로나 + 주요 질환(암, 기타 감염병) 검체로 확대
< 의료기기산업 종합지원센터 >
(체외진단의료기기 검증 지원 코디네이팅)
< 전문기관 네트워크 >
(제품 평가계획 검토 및 검증)
유관협회 협조
(진단검사의학회 등)
체외진단기기 제품 평가계획 검토
의료기관 A
의료기관 B
의료기관 C
전문 평가기관 매칭 및 임상검체 보유 DB관리
→
매칭된 기업 제품의 임상적 성능시험 수행 및 임상 컨설팅 지원
❷ 주력분야(치과, 영상진단 등) 기술 고도화
○ (프리미엄 기술력 확보) 치과‧영상진단‧광학 등 국내‧외 산업 기반을 보유한 분야의 핵심 기술력 확보를 위해 범부처 R&D 등 추진
* 범부처 전주기 의료기기 연구개발 사업(’20~’25, 복지‧과기‧산업‧식약) 中 60개 과제, 영상진단의료기기 탑재용 AI기반 영상분석 솔루션 개발(’20∼’24, 산업부, 271억원)
초음파 영상기기
치과 임플란트
- (현황) 국내 의료기기수출 1위(4억 8천달러, ’19년도), 중저가 위주의 시장 구조 및 임상적 차별성 부재
- (지원) 융합영상 및 생검 장치 핵심기술, 융합영상기기 등의 개발 지원
- (현황) 임플란트 실적(국내생산1위, 수출 2위) 대비, 치료재료 수입 비중 높음
- (지원) 프리미엄 디지털 구강스캐너, 3D 소프트웨어, 지능형 치과진단 및 보철치료 통합솔루션 개발 등 기술 확보 지원
○ (교육·훈련) 의사·간호사·의대생 등 대상별 임상교육 프로그램에 국산제품을 활용하여, 다수 제품 홍보 및 신뢰 구축 지원
- 의료기술시험연수원(’24년 완공)에 주력분야 교육센터 설립 추진
❸ 해외진출 역량 강화
○ (사용적합성 평가 지원) 국산의료기기 사용적합성평가 센터* 운영을 통해 국내외 의료기기 규격 강화에 대응, CE인증, FDA 통과 등 지원
* 고대 구로·서울대(’18∼’21), 분당서울대 병원(’20∼’23) 지정·운영 중(센터당 1억원)
○ (국제인증센터 구축) 지자체 공모를 통해 의료기기 국제인증지원센터*를 구축하여 해외 인증 대응 기능 통합 및 강화 추진(’22~, 1개소, 신규)
* 해외 인증 통합정보 구축, 전문인력 양성, 인증지원사업 수행 등
○ (글로벌 진출 지원) 해외 유통망을 보유한 글로벌 기업과의 전략적 제휴(ODM 등)* 확대(2.5억원), 해외 인증기준 강화에 컨설팅 등 지원** 추진
* (면역진단) A사 전체 매출액의 50%는 로슈 ODM을 통해 유럽에서 발생 / (분자진단) PCR 장비회사가 인허가 권리 보유 → 진단시약 기업 단독으로 최대시장인 미국진입에 한계
** 유럽 인허가 강화(IVDR)에 대응한 컨설팅(’22~, 복지부), 해외 인허가 기술문서 작성 지원 및 국산·외산 의료기기 성능, 내구성 등 종합 비교·평가(’20∼, 산업부)
전략③
혁신성장을 위한 정책적 지원
◈ 기술 발전 속도에 맞는 규제 개선 및 지원 인프라 고도화를 통한 의료기기 산업 혁신 생태계 조성
진단
추진방향(~‘25)
지속적인 정책추진 동력 확보를 위한
지원 기능 필요
지원기관 기능을 강화하여 현장 친화적, 문제해결형 거버넌스 구축
기술의 발전 속도에 맞는 규제 체계 필요
신의료기술 평가 및 심사절차 개선 등을 통해 합리적인 규제 추진
의료기기 관련 정보가 산재되어 있으며 사용자가 필요로 하는 정보가 부족
실태조사를 바탕으로 한 정보 제공 플랫폼 구축
❶ 정책 지원 강화
○ (지원기관 기능 강화) 의료기기산업 종합지원센터를 다분야 전문가가 모여 기업 애로사항을 직접 해결해주는 통합 허브로 운영
○ (제도개선 협의체) 유관기관 간 의료기기 제도개선 협의체 정례화, 복합적인 규제‧제도개선 필요사항을 발굴하여 통합검토(월 1회)
* 복지부, 식약처, 보건산업진흥원, 건강보험심사평가원, NECA 등
의료기기산업 종합지원센터
기업육성 ‧ 제도개선
병원 인프라 연계
통합상담 운영
▪혁신형 의료기기기업 인증지원
▪혁신의료기기군 지정
▪통합정보 시스템 구축‧운영
▪산업 실태조사
▪병원 인프라 통합 임상연구 협의체 운영
▪기업-병원 및 병원 간 연계
* 혁신의료기기 실증지원센터, 체외진단 임상평가 네트워크, 사용적합성센터, 교육훈련센터, 데이터중심병원 등
▪유관기관 통합 시장진출 상담
* NECA, 심평원, 식약처 등
▪분야별 민간전문가 활용
▪규제개선 협의체 운영
▪지역 클러스터 연계
❷ 산업 규제 합리화
○ (신의료기술평가 개선) 선진입 대상을 확대하여 시장검증 기회를 제공, 신의료기술평가 통과율 제고를 위한 맞춤형 컨설팅 실시
* 우수 의료기술의 의료현장 진입·확산을 위한 전주기적 컨설팅 시행
○ (심사절차 개선) 혁신의료기기의 신속한 시장 출시를 지원하기 위한 허가·심사 특례 개선* 등 신속제품화 지원 내실화(’21~, 식약처)
* 단계별 심사 신청 시 첨부서류 간소화 및 승인절차를 생략하여 심사절차 개선
○ (인허가 갱신제) 허가‧인증‧신고 의료기기 안전성‧유효성을 주기적(5년) 재검토*, 실사용 제품 위주로 안전 관리 강화(’20~, 식약처)
* (기존) 시판후 이상사례 발생 등 안전성 유효성 재검토 필요시에 재평가 시행→ (개선) 정기 갱신제 도입을 위한 안전성·유효성 검증 체계 구축
❸ 통합 정보제공 체계 구축
○ (실태조사 실시) 국산 의료기기 사용현황 등 의료기기산업 정책 수립 기초자료 마련을 위한 정기 실태조사* 실시(’22, 3년 주기, 의료기기산업법 제9조)
* 의료기기산업 시장 규모, 국내외 투자현황, 기술경쟁력, 연구개발 현황 등
○ (통합정보 플랫폼 구축) 현장에서 필요하나 산재되어 있는 의료기기 관련 정보를 통합적으로 제공하는 플랫폼 구축‧운영(’22~, 신규)
* 보건산업진흥원을 혁신의료기기 정보관리기관으로 지정하는 고시 제정 (’21)
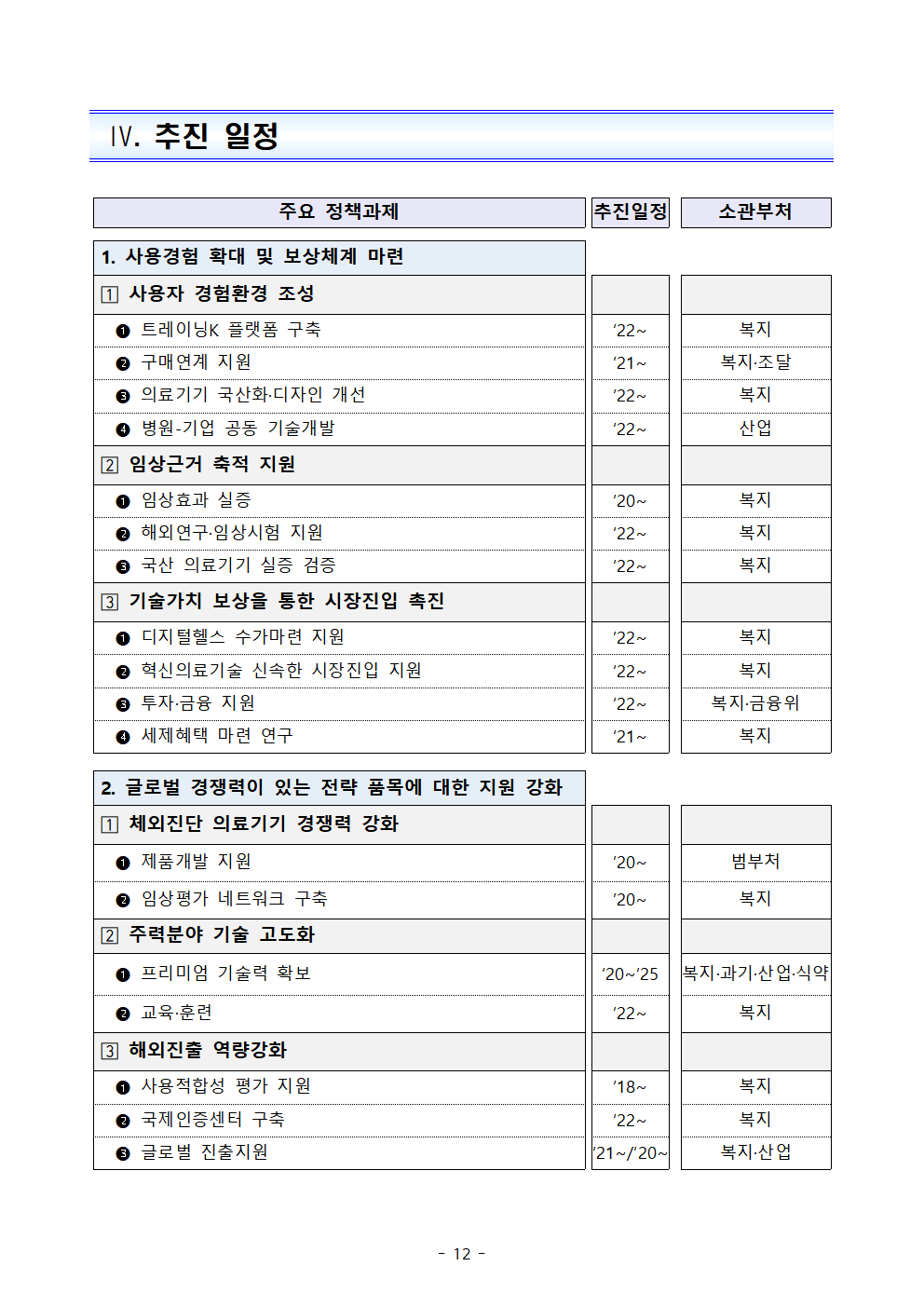
Ⅳ. 추진 일정
주요 정책과제
추진일정
소관부처
1. 사용경험 확대 및 보상체계 마련
? 사용자 경험환경 조성
트레이닝K 플랫폼 구축
‘22~
복지
구매연계 지원
‘21~
복지·조달
의료기기 국산화·디자인 개선
‘22~
복지
병원-기업 공동 기술개발
‘22~
산업
? 임상근거 축적 지원
임상효과 실증
‘20~
복지
해외연구·임상시험 지원
‘22~
복지
국산 의료기기 실증 검증
‘22~
복지
? 기술가치 보상을 통한 시장진입 촉진
디지털헬스 수가마련 지원
’22~
복지
혁신의료기술 신속한 시장진입 지원
‘22~
복지
투자·금융 지원
‘22~
복지·금융위
세제혜택 마련 연구
‘21~
복지
2. 글로벌 경쟁력이 있는 전략 품목에 대한 지원 강화
? 체외진단 의료기기 경쟁력 강화
제품개발 지원
’20~
범부처
임상평가 네트워크 구축
’20~
복지
? 주력분야 기술 고도화
프리미엄 기술력 확보
‘20~’25
복지·과기·산업·식약
교육·훈련
’22~
복지
? 해외진출 역량강화
사용적합성 평가 지원
‘18~
복지
국제인증센터 구축
‘22~
복지
글로벌 진출지원
‘21~/‘20~
복지·산업
3. 혁신성장을 위한 정책적 지원
? 정책지원 강화
지원기관 기능 강화
‘21~
복지
제도개선 협의체
‘21~
복지
? 산업 규제 합리화
신의료기술평가 개선
’21~
복지
심사절차 개선
‘21~
식약
인허가 갱신제
‘20~
식약
? 통합 정보제공 체계 구축
실태조사 실시
‘22~
복지
통합정보 플랫폼 구축
‘22~
복지
미래 '정밀의료' 선도를 위한
국가 통합 바이오 빅데이터
구축·활용계획(안)
Ⅰ. 추진 배경
◇ 글로벌 바이오헬스 시장의 급성장 속에서, 데이터 기반 정밀의료*가 바이오헬스 산업의 미래 발전을 주도할 것으로 전망
* (정밀의료, Precision Medicine) 유전체·임상·개인생활습관정보 등을 토대로 환자 각 개인을 정밀하게 분석, 최적의 맞춤의료(예방·진단·치료)를 제공하는 차세대 의료 패러다임
※ (글로벌 바이오헬스 시장 전망) 1,756조원(’15) → 2,959조원(’25), (2018, GHIO)
○ 유전체 분석*·ICT 기술 발전에 따라, 의료 패러다임이 전통적 치료 중심에서 개인 맞춤형 정밀의료 중심으로 빠르게 전환되고 있음
* 1인당 유전체분석 소요비용(평균) : (’03) 27억$ → (’17) 1,000$ → (’20) 500$ (추정)
< 의료 패러다임 트렌드 변화 >
◇ 개인 맞춤형 정밀의료 실현을 위해서는, 개인 중심으로 대규모 통합(유전체+임상+개인생활습관정보 등) 바이오 빅데이터 필요
○ 빅데이터 구축 및 장기 추적을 통해, 주요 질환의 원인 규명 및 진단·치료 기술 혁신을 위한 국가 전략인프라로 활용
- 코로나-19와 같은 범유행 전염병 발생 시 신속한 백신·치료제 임상연구 지원 등을 위해서도 국가적인 바이오 빅데이터 필요
* (美, 모더나) 빅데이터 기반 솔루션(메디데이터社)을 활용하여 신속한 백신 후보물질 임상시험, (英) Genomic England의 2만명 바이오 빅데이터 기반 COVID-19 연구 중
○ 美, 英, 中 등 주요국도 국가 차원의 바이오 빅데이터 구축·고도화 중
* (美) All of US(’18~, 100만명) / (英) 100K Genomes Project(‘12~18, 10만건), UK Biobank(’06~, 50만명) / (中) China National GeneBank(’16~, 100만명) 등
◇ 우수한 의료기술·인력 및 ICT 기반 높은 정보화 수준, 탄탄한 유전체 연구역량 등 빅데이터 활용을 위한 기반은 우수한 수준
○ 대형의료기관 중심으로 의료기관의 정보화 도입*, 임상 현장 ICT 활용** 등이 지속 확대 추세 (보건의료정보화 실태조사, ’20)
* (의무기록→전자의무기록(EMR) 완전 전환율) 상급종합병원: 71.6%(’17) → 85.7%(’20), 종합병원급: 66.8%(’17) → 72.4%(’20, 300병상 이상)
** (임상의사결정 지원시스템 활용률: 이상검사 결과 알림) 상급종합병원 100%,300병상 이상 종합병원 89.9% 등
- 의료기관의 데이터 표준화 및 개방·활용 확대를 위해, 의료데이터 중심병원(’20~) 등 의료기관 지원 정책도 지속 추진 중
○ 유전체·바이오 및 정밀의료 분야에 대한 지속적인 지원*을 통해, 관련 분야의 연구 역량도 꾸준히 강화되어 왔음
* 한국인유전체역학조사사업(’01~, 1,144억), 포스트게놈 다부처유전체사업(’14~22, 5,400억), 울산1만명 게놈프로젝트(’16~19, 108억), 정밀의료 기반 암진단·치료법 개발(’17~21, 430억) 등
◇ 그러나 기존 연구는 소규모 질환연구 목적으로 분산 추진, 데이터가 파편화되었으며, 활용 동의 수준도 상이하여 정밀의료 연구 활용 한계
○ (소규모 코호트) 기존 데이터는 특정 질환연구 목적으로 최소 규모로 구축되어, 범용적 질환 대상 정밀의료 연구자원으로 활용 한계
○ (자원 파편화) 연구기관·연구자별로 데이터가 분산, 파편화되어 있고 참여자의 데이터 활용 동의 수준*도 상이하여, 외부의 데이터 접근 어려움
○ (통합·추적관리 필요) 정밀의료 연구를 위해 유전체·임상정보 뿐만 아니라 공공데이터(국가건강검진, 예방접종 등), 개인생활습관정보(Lifelog) 등 개인 중심의 통합 바이오 데이터를 구축하고 이를 지속적으로 추적관리 필요
☞ 정밀의료 실현을 위해서는 기존 연구자원의 한계를 뛰어넘는 100년 大計의 국가전략자산으로서 바이오 빅데이터 구축 절실
* (1960년대)경부고속도로⇒(1990년대)초고속통신망⇒(2020년대)통합 바이오 빅데이터
주요국 바이오 빅데이터 정책 현황
◇ 주요국은 글로벌 정밀의료 시장 선점을 위해, 경쟁적으로 국가 차원에서 바이오 빅데이터 구축 및 관련 투자를 지속 확대 중
(미국) 정밀의료 이니셔티브('15)에 따라, 100만명 바이오 빅데이터 구축
○ ’15년 오바마 정부의 정밀의료 이니셔티브* 발표 후 ’18년부터 100만명의 바이오 빅데이터를 구축하는 All of US** 사업 추진 중
* 암 치료법 개발, 연구 코호트 구축 등 대규모 정밀의료 연구 계획을 제시
** 미 NIH 주도로 100만명의 유전체(검체), 의무기록, 생활습관정보 등을 수집하여 대규모 바이오 빅데이터를 구축하고, 이를 개인 맞춤형 정밀의료 개발에 활용
(영국) 국가 주도하에 선도적으로 정밀의료 연구자원 구축·활용 중
○ 세계 최대 규모의 바이오 빅데이터*를 구축하여, 연구·임상 등에 적극 활용 중, 이후 500만명 규모로 확대 추진 발표(’18)
* (100K Genomes Project) 희귀질환자, 암 환자 등 10만건의 전장유전체 정보와 英 NHS(National Health Service) 임상정보를 연계하여 빅데이터 구축·개방(’13~18)
** 정밀의료 연구를 위해 영국인 50만명 코호트 구축·운영 중(UK-Biobank, ‘06~)
(중국) 정밀의료발전계획('16)에 따라 100만명 빅데이터 구축 추진 중
○ 베이징게놈연구소(BGI) 주도로 유전체·임상정보를 포함한 100만명 규모의 정밀의료 코호트 구축 추진(’16~)
* (China National GeneBank, CNGB) 중국정부 지원하에 BGI 주도로 구축한 세계 4위의 유전자은행으로, 인간 뿐만 아니라 식물, 미생물 등의 다양한 유전체 보유
Ⅱ. 그간 추진경과
□ 국가 바이오 빅데이터 구축 결정 ('19.4, 과학기술관계장관회의)
○ 미래의료 선도 및 바이오헬스 산업 혁신을 위해, 범정부 합동으로 100만명 국가 바이오 빅데이터 구축 추진('19.5, 바이오헬스 산업 혁신전략)
- 1단계로 2.5만명 규모 바이오 빅데이터 구축 시범사업 추진(’20~)
□ 국가 바이오 빅데이터 구축 시범사업 및 본사업 준비 ('20~)
○ (시범사업) 대규모 바이오 빅데이터 구축에 앞서, 사업 추진체계 실증을 위한 범부처* 합동 시범사업 추진(’20~)
* (참여부처) 보건복지부(간사), 과학기술정보통신부, 산업통상자원부, 질병관리청
< 시범사업 주요내용 및 성과 >
ㅇ (희귀질환자 모집) 희귀질환 협력병원(16개소)을 통해, 희귀질환자 총 1.5만명 모집(1차년도 5천명 모집 완료 → 2차년도 1만명 모집 예정)
ㅇ (선도사업 연계) 기존 선도사업으로부터 제3자 제공에 동의한 총 1만명 바이오 데이터 연계(1차년도 5천명 연계 완료 → 2차년도 5천명 연계 예정)
* (연계대상사업) 한국인유전체역학조사사업(KoGES), 울산1만명 게놈프로젝트 등
ㅇ (데이터 생산·관리) 검체로부터 고품질 바이오 데이터 생산, 데이터 변이분석·품질관리 및 희귀질환자 진료 지원을 위한 진단참고용보고서 제공 중(’20.12~)
ㅇ (활용기반 마련) 안전하고 효율적인 데이터 관리·제공을 위해 임상·유전체 관리시스템 구축(~’20.10) 및 클라우드 기반 분석지원 플랫폼 단계별 구축(~’21.6)
- (성과 창출 지원) 효율적인 연구수행 지원을 위한 연구네트워크 구성(’21.4) 및 데이터 개방심의체계 마련(’21.5), 연구과제 지원(’21.3~) 등 추진
○ (본사업 준비) 총괄기획위원회·분과위원회 등 전문가 논의 및 수요조사, 공청회 등 의견수렴을 거쳐 범정부 공동기획안 마련(~21.5)
* 기획 완성도 제고를 위해 예비타당성조사 사전컨설팅(’21.1~3, STEPI) 수행
Ⅲ. 본사업 계획(2023-2028) 주요내용
1
비전 및 전략
비전
정밀의료 글로벌 선도국가 TOP 5 도약
목표
미래의료 · 산업 혁신을 위한 정밀의료 기반 구축
핵심
가치
Bigdata
Integration
Optimization
정밀의료 실현을 위한 대규모 빅데이터 구축
동의 기반으로 통합 연구자원 구축
빅데이터 기반 연구· 산업화 활용 극대화
3대
전략
참여자 동의 기반
100만명 빅데이터
구축·추적관리
▶
바이오 빅데이터
개방·활용을 위한 데이터 댐 구축
▶
빅데이터 기반 정밀의료 연구 및 산업화 과제 지원
추진
과제
1. 참여자 모집 및 정보 수집
▶
1. 통합 바이오 데이터 댐 구축
▶
1. 고부가가치 바이오 데이터 생산 연구
2. 정밀의료 선도과제 연구 지원
2. 인체유래물 바이오뱅킹
2. 안전한 데이터 활용환경 구성
3. 산업 연계형 新비지니스 창출
3. 바이오 데이터 생산
3. 사회적 거버넌스 수립·운영
4. 유전체 분석기술 및 장비 개발
4. 데이터 추적·환류
투입
100만명 규모 참여자
(선도사업 30만명 포함)
총 6년간 약 9,878억원
(민간 339억원 포함)
총 1,557명 참여
2
사업 개요
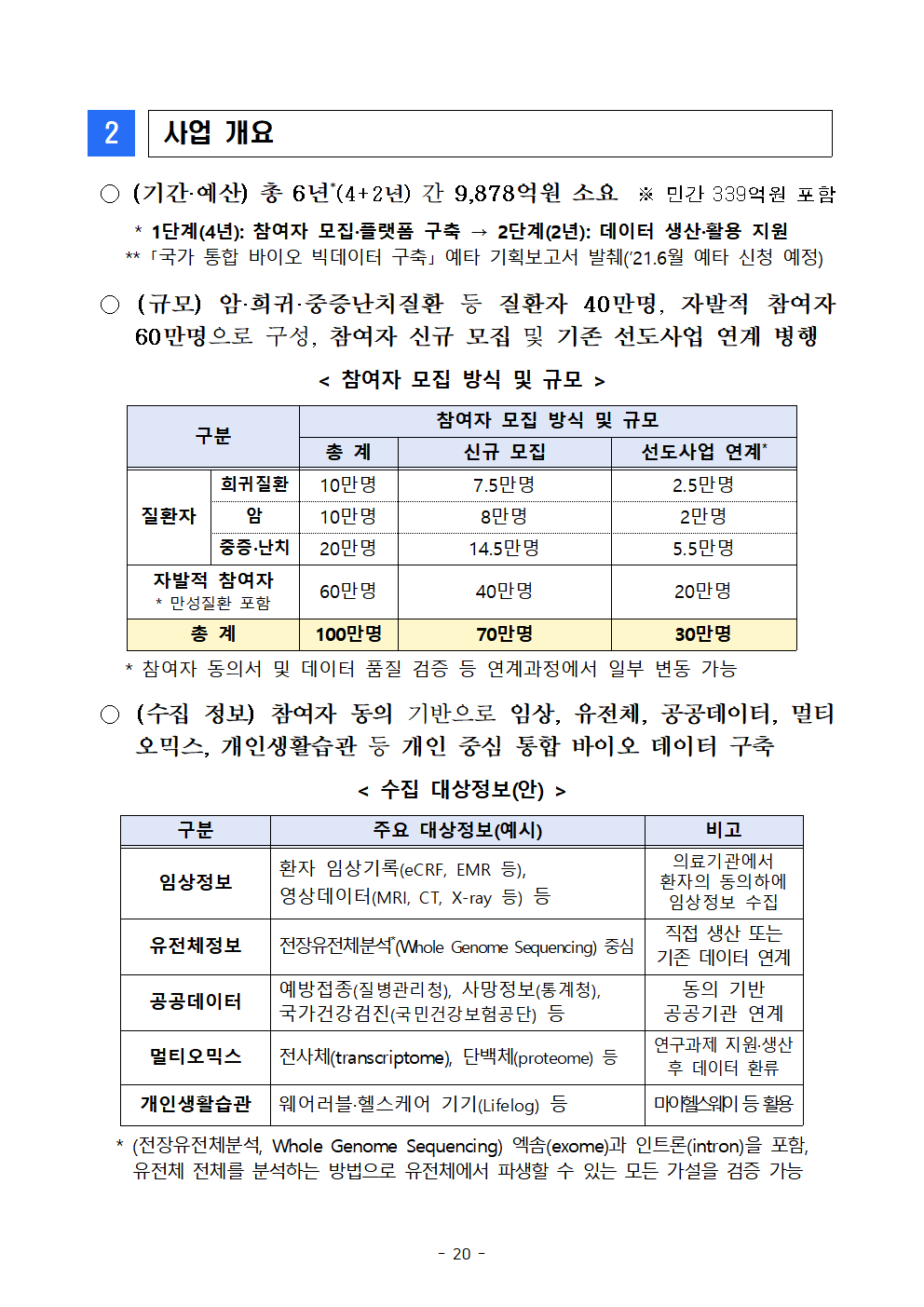
○ (기간·예산) 총 6년*(4+2년) 간 9,878억원 소요 ※ 민간 339억원 포함
* 1단계(4년): 참여자 모집·플랫폼 구축 → 2단계(2년): 데이터 생산·활용 지원
** 「국가 통합 바이오 빅데이터 구축」 예타 기획보고서 발췌(’21.6월 예타 신청 예정)
○ (규모) 암·희귀·중증난치질환 등 질환자 40만명, 자발적 참여자 60만명으로 구성, 참여자 신규 모집 및 기존 선도사업 연계 병행
< 참여자 모집 방식 및 규모 >
구분
참여자 모집 방식 및 규모
총 계
신규 모집
선도사업 연계*
질환자
희귀질환
10만명
7.5만명
2.5만명
암
10만명
8만명
2만명
중증·난치
20만명
14.5만명
5.5만명
자발적 참여자
* 만성질환 포함
60만명
40만명
20만명
총 계
100만명
70만명
30만명
* 참여자 동의서 및 데이터 품질 검증 등 연계과정에서 일부 변동 가능
○ (수집 정보) 참여자 동의 기반으로 임상, 유전체, 공공데이터, 멀티오믹스, 개인생활습관 등 개인 중심 통합 바이오 데이터 구축
< 수집 대상정보(안) >
구분
주요 대상정보(예시)
비고
임상정보
환자 임상기록(eCRF, EMR 등), 영상데이터(MRI, CT, X-ray 등) 등
의료기관에서 환자의 동의하에 임상정보 수집
유전체정보
전장유전체분석*(Whole Genome Sequencing) 중심
직접 생산 또는 기존 데이터 연계
공공데이터
예방접종(질병관리청), 사망정보(통계청),
국가건강검진(국민건강보험공단) 등
동의 기반 공공기관 연계
멀티오믹스
전사체(transcriptome), 단백체(proteome) 등
연구과제 지원·생산 후 데이터 환류
개인생활습관
웨어러블·헬스케어 기기(Lifelog) 등
마이헬스웨이 등 활용
* (전장유전체분석, Whole Genome Sequencing) 엑솜(exome)과 인트론(intron)을 포함,유전체 전체를 분석하는 방법으로 유전체에서 파생할 수 있는 모든 가설을 검증 가능
3
3大 전략별 추진과제 주요내용
(전략1) 동의 기반 100만명 바이오 빅데이터 수집·생산
◇ 질환자 및 자발적 참여자 모집, 선도사업 연계 기반으로 대규모 인체자원 수집 및 데이터 생산·정제·품질관리 등을 통해, 개인 맞춤형 정밀의료를 위한 고품질 바이오 빅데이터 구축
① (참여자 모집·정보 수집) 개인 동의 기반으로 질환자 40만명*, 자발적 참여자 60만명** 등 참여자 모집 및 바이오 데이터 수집
* (질환별 모집규모(안)) 희귀질환: 10만명, 암환자: 10만명, 중증·난치질환: 20만명
** (자발적 참여자) 고혈압, 당뇨 등 만성질환 포함, 연령별·성별·지역별 다양성 확보
- (선도사업 연계) 기존 정부지원 연구개발 사업, 민간 코호트 발굴 및 동의서 기반으로 약 30만명의 바이오 데이터 연계
* (정부지원 선도사업) 한국인유전체역학조사사업(KoGES), 울산1만명게놈프로젝트, 포스트게놈 다부처유전체사업, 정밀의료 기반 암진단·치료법 개발(K-MASTER) 등
100만명 바이오 빅데이터 구축 필요성
ㅇ 한국인 호발 질환 중 발생빈도 및 사회적 파급력 등을 고려, 선정된 연구대상 질환에 대한 정밀의료 연구를 위해 최소 100만명 바이오 빅데이터 구축 필요
* (우선 연구대상) 희귀질환, 주요 호발 암, 주요 중증·난치질환 및 만성질환
- 관련 학회 등 전문가 수요조사 결과, 정밀의료 연구를 위해서는 질환별로최소 5천명 이상의 바이오 빅데이터 연구자원(코호트) 확보 필요
- 발생 빈도가 낮으나 사회적 파급력이 높은 질환* 연구를 위해서는, 최소 100만명 바이오 빅데이터 구축 및 10년 이상 장기 추적관찰 필요
* 연간 발생빈도가 10만명당 50명 질환 → 10년 추적 시, 5,000명 규모 코호트 형성
- 해외 주요국들도 100만명 규모로 바이오 빅데이터 구축 중(美, 中, 유럽연합 등)
② (인체유래물 바이오뱅킹) 수집된 검체(피·뇨·조직 등)는 국립중앙인체자원은행(국립보건연구원 소재) 기탁하여 반영구적으로 보관·관리
- 전국적인 인체자원 수집-이송-보관 및 모니터링 체계 구축 및 자동화 설비 도입을 통해 자원 관리의 효율성·안정성 제고
③ (바이오 데이터 생산) 고품질 유전체 데이터 생산(전장유전체분석 중심) 및 변이분석, 품질관리를 거쳐, 임상·개인생활습관정보 등과 결합하여 개인 단위의 통합 바이오 데이터 생산
④ (데이터 추적·환류) 2차자료 연계 등을 통한 질병 발생 및 예후, 동반 질환 정보 등 참여자 데이터 지속 추적·환류체계 마련
- 건강보험공단, 국립암센터 등 공공기관에서 보유한 국가건강검진, 암 정보 등 주요 보건의료 공공데이터 연계 및 지속 추적·관리
- 민간 의료기관 및 헬스케어 사업자 정보 수집을 위해, 마이헬스웨이*(의료 마이데이터) 플랫폼 활용 및 주기적 정보제공 참여 독려
* (마이헬스웨이: 의료 마이데이터 플랫폼) 개인 주도로 자신의 건강정보를 한 곳에 모아, 원하는 대상에게 제공하거나 직접 활용하도록 지원함으로써, 개인정보가 본인 주도로 원활하고 안전하게 활용될 수 있도록 돕는 플랫폼
< 데이터 연계 대상기관 및 정보(안) >
구분
대상기관
수집데이터
연계(활용)
의료기관
상급종합병원 45개소, 종합병원 약 300개소 등
· 진료·진단기록
· 투약, 검사기록
· 영상데이터(X-ray, MRI 등)
동의 기반 직접 수집, 마이헬스웨이
공공기관
건강보험공단, 통계청, 심사평가원, 국립암센터 등
· 국가건강검진
· 청구·진료내역
· 암 정보, 예방접종, 사망정보
직접 연계
헬스케어 사업자
삼성전자, LG, SKT, KT, 애플 등 민간기업
· 심박, 심전도 수치
· 운동량, 활동량 기록
· 혈당, 혈압 등
마이헬스웨이
< 연구자원 수집 및 생산체계 개념도(안) >
(전략2) 국가 통합 바이오 데이터 댐 구축·운영
◇ 대규모 민감정보인 바이오 빅데이터의 원활하고 안전한 활용 및 사회적 공감대 형성을 위해, 표준작업절차(SOP) 수립 및 플랫폼·활용지원체계 구축, 민·관 거버넌스 및 사업단 구성 추진
① (데이터 댐 구축) 임상·유전체·멀티오믹스·공공정보 등 바이오 빅데이터 표준화, 품질관리 등 표준작업절차(SOP) 수립 및 플랫폼(H/W) 구축
② (데이터 활용환경 구성) 대용량 민감정보를 안전하게 활용·연구할 수 있도록 슈퍼컴퓨팅 기반 보안 분석환경 구축, 분석·연구 결과 환류
③ (데이터 거버넌스) 대규모 민감정보 활용에 따른 사회적 협치 및 전문가 자문을 위한 민·관 거버넌스 구축(산·학·연·병 및 시민사회 참여)
- 안정적 빅데이터 관리·활용 지원을 위한 전담 사업단 구성 및 협력체계 마련
* 데이터 접근 및 분양체계, 데이터 반입·반출, 지식재산권 가이드라인 마련 등
< 국가 통합 바이오 빅데이터 댐 개념도 >
(전략3) 데이터 활용 지원을 통한 연구·활용 성과 극대화
◇ 임상·역학·멀티오믹스 등 데이터 기반 연구과제 지원 및 비즈니스 모델, 유전체 분석기술·장비 개발 등 산업화 과제 지원을 통해, 국가 통합 바이오 빅데이터 기반 성과 창출 극대화
① (고부가가치 바이오데이터 생산) 연구 목적에 따라 유전체·임상정보 등 기존 정보 외 추가 바이오 데이터* 구축·활용 연구 지원
* (고부가가치 바이오데이터 생산) 전사체(RNA), 단백체(proteome), 디지털 건강정보 등 추가정보 생산·활용 및 환류하는 일련의 과정
** (사례) TCGA(美), 조기 위암 유전단백체 연구(고려대) 등의 사례에서, 유전체 뿐만 아니라 단백체·전사체 분석을 통해 암종분석 등 주요 성과를 도출
② (정밀의료 선도과제 지원) 개인 맞춤형 정밀의료 실현을 위해, 데이터 기반 임상·역학연구 등 정밀의료 기술개발 연구과제 지원
* (사례) 표적치료제 이매티닙(Imatinib)을 통해 골수성백혈병 5년 생존률 2배로 증가, 와파린 처방 시 유전적 정보를 반영하여 심장질환자 입원 비율 30% 감소 등
연구 예시
①빅데이터 활용을 통한 신속한 감염병 백신 개발*, ②유전적 기작 등 질환의 원인 규명 연구, 유전자-임상정보 연관 분석을 통한 ③새로운 진단 바이오마커 발굴, 빅데이터 기반 ④치료 예방인자 발굴 및 약물치료 효과 증대 등 다양한 정밀의료 기술개발 연구 기획·공모·지원
* 美 모더나社는 백신 후보물질(mRNA-1273) 개발 시 신속한 임상시험 및 연구 전반 지원을 위해, 메디데이터社(Medidata)의 빅데이터 기반 클라우드 솔루션 활용
③ (산업 연계형 新비즈니스 창출) 기업수요 기반 맞춤형 데이터셋 구축 및 비즈니스 모델 개발·실증을 위한 산업 연계형 데이터 활용 플랫폼 구축
* (사례) 중환자 생체신호 분석을 통해 급성질환 발생 사전 알림 등 병원 내 환자 맞춤형 케어서비스, 환자 바이오데이터에 기반한 식단·운동 관리 및 맞춤형 화장품 추천 등 개인 맞춤형 헬스케어 서비스 등이 출시되었음
④ (유전체 분석기술·장비 개발) 검체채취-핵산추출-전처리-염기서열 분석 등 유전체 분석단계별 핵심기술 및 장비, 소모품 국산화 개발 지원
※ 국가 바이오 데이터 스테이션*과 연계를 통해, 융합연구 활성화 및 바이오 데이터 활용도 극대화 추진
* 정부 바이오 R&D에서 생산된 모든 데이터를 수집‧연계하여 실물 소재와 데이터를 산‧학‧연 연구자에게 제공하는 플랫폼으로 과기부 등 관계부처 공동으로 구축 중(’21~)
4
사업 추진체계
◇ 대규모 민감정보의 안정적 수집·운용·관리를 위해, 범부처 협력하에 사업 거버넌스 체계 구축 및 전담 기구(사업단) 지정·운영
□ 주요 기능 및 역할
○ (이사회) 최고 의결기구로서 범부처 및 민간전문가 등으로 구성
○ (사업단) 국가 통합 바이오 빅데이터 구축 사업 운영 및 실무 총괄
* 사업 종료(~’28) 후, 구축된 통합 바이오 빅데이터의 안정적인 관리 및 원활한 활용 지원을 통한 성과 창출 확대를 위해, 「바이오 빅데이터 센터」 설립 추진
○ (자문·협의) 분야별 전문가 자문을 위한 전문위원회, 표준화된 데이터 구축·관리를 위한 표준화위원회, 보건의료 정보의 관리·연계·개방 등을 논의하고자 유관기관 협의체 등 설치·운영
○ (윤리·보호) 윤리적·법적·사회적 함의를 논의하는 ELSI 위원회*, 정보 오·남용 방지, 가명처리 적정성 등을 검증하는 개인정보보호위원회
* (Ethical, Legal & Social Implication : ELSI 위원회) 인간 유전체 등 민감한 정보를 다루는 생명과학기술에 대한 윤리적, 법적, 사회적 이슈에 대한 논의 기구
< 사업 추진 거버넌스 체계(안) >
Ⅳ. 기대 효과
□ 의료의 질 향상 및 예방‧개인맞춤형 치료의 획기적 발전 견인
○ 환자는 부모 등 가족과의 가계도 분석 등을 통해, 질환의 원인이 되는 유전자를 빅데이터로 발견 → 질병 원인 규명 및 진단‧치료에 활용
* (예시) 희귀질환의 진단률 제고 및 신규 진단·치료법 개발, 한국인 호발 암, 주요 사망원인질환 등을 중심으로 맞춤형 진단‧치료법 개발 등
○ 일반인은 분석보고서를 활용하여 잠재적 발병 확률을 확인하고, 주의가 필요한 약물, 식이조절 등 맞춤형 관리를 통해 질병 예방
○ 범유행 감염병 발생 시, 대규모 바이오 빅데이터를 활용하여 백신·치료제 개발 지원 등 신속한 대처 가능
□ 바이오 빅데이터를 활용한 바이오헬스 신산업 선점·촉진
○ 국내 유전체 분석 및 정밀의료 서비스 시장 활성화로 글로벌 진출의 발판 마련, 혁신신약 및 신개념 융합 의료기기 개발 기여
* (예시) 유전체분석, 정밀의료 기반 건강관리서비스 시장 창출, 유전체 분석 장비‧기술 국산화, 기존 연구과 연계를 통한 신약‧융합의료기기 개발 촉진 등
< 바이오 빅데이터 주요 활용방안 및 사례 >
Ⅴ. 향후 추진일정
□ 시범사업 1차년도 사업 종료(~’21.5월)
○ 1차년도 주요 사업성과* 검토
* (주요 사업성과) 희귀질환자 5천명 모집 및 선도사업 데이터 5천명 연계, 유전체 데이터 생산 및 변이분석, 품질관리 체계 구축, 데이터 활용지원 플랫폼 구축 등
□ 본사업 추진
○ 국가연구개발사업(R&D) 예비타당성조사 신청(’21.6월)
○ 본사업 착수(’23~) 추진
참고1
정밀의료 및 표적치료 개념
□ 정밀의료(Precision Medicine)
○ 유전체, 임상정보, 생활환경, 습관정보 등을 토대로 정밀하게 환자 각 개인을 분류하고, 이를 고려하여 최적의 맞춤의료(예방, 진단, 치료)를 제공하는 차세대 의료 패러다임*
* (4P 의학) 라이프스타일 관리를 통해 환자 개인의 질병을 예방(Preventive)하고, 질병 발생을 예측(Predictive)하며, 질병 치료도 개인 특성에 맞추는(Personalized) 개념으로, 환자들의 자발적인 참여(Participatory)를 통해 이루어짐
< 사례: BRCA 1, 2(breast cancer susceptibility genes 1 and 2) >
- BRCA는 종양억제 유전자(비정상세포 성장을 억제하는 단백질 생산)로, 전체 유방암 5∼10%, 난소암 10∼15%가 BRCA 유전자 돌연변이로 인한 유전성으로 추정
- BRCA 1, 2의 유전성 돌연변이를 가진 여성이 일생 동안 유방암이 발생할 위험도는 약 60∼80%, 난소암이 발생할 위험도는 약 15∼45%
□ 표적치료(Targeted Therapy)
○ 질병 원인이 되는 유전자 발현을 억제하는 치료로, 폐암 환자에 투여되는 EGFR TKI가 대표적인 표적 치료제
- (EGFR* TKI**) EGFR를 활성화시키는 tyrosine kinase를 선택적으로 억제, 암세포의 생존·증식·전이를 막는 약제
* (EGFR, epithelial growth factor receptor) EGF가 결합할 수 있는 세포막 당단백질 수용체로, tyrosine kinase 활성도를 가짐
** (TKI, tyrosine kinase inhibitor) tyrosine kinase는 암세포의 성장·분화·생존의 신호전달 경로를 활성화시키는 중요한 매개 효소로, 이를 억제하는 것이 TKI
< EGFR 표적 치료제 >
기전
약제
1세대
EGFR의 ErbB1만을 차단
geftinib(Iressa®)
erlotinib(Tarceva®)
2세대
ErbB Family 차단제
afatinib(Giotrif®)
3세대
비가역적으로 변이형태(T790M)의 EGFR에 결합
Osimertinib(Tagrisso®)
참고2
주요 유전체 데이터 생산(DNA Sequencing) 방법
○ 전장 유전체 분석(전장유전체시퀀싱, Whole Genome Sequencing, WGS)
- 엑손(exon)과 인트론(intron)을 포함한 유전체 전체를 분석하는 방법으로, 비용이 비싸고 낮은 시퀀싱 깊이로 분석정확도가 낮으나,
- 엑솜, 타켓패널 시퀀싱을 통해서는 불가능한 유전체에서 파생될 수 있는 모든 가설을 검증할 수 있어, 정밀의료 연구자원으로 적합
* (WGS 추진 사례) 100K Genomes Project(英, 10만건 完), All of US(美) 등
○ 엑솜 분석(엑솜 시퀀싱, Whole Exome Sequencing: WES)
- 엑손(exon)* 부위만을 분석하는 방법으로, WGS에 비해 비용이 비교적 저렴하고 분석에 소용되는 시간이 적어 효율적
* 전체 유전체의 1∼2%를 차지하며 단백질을 직접 코딩하는 부위로, 대부분의 질환 연관 돌연변이가 엑손에 위치
○ 타겟 패널 분석(타켓 패널 시퀀싱, targeted panel sequencing)
- 특정 질병에 부합하는 유전자들로만 구성된 패널을 분석하는 방법으로, 비용이 저렴하고 높은 시퀀싱 깊이로 분석정확도가 높음
< 유전체 데이터 생산(DNA 시퀀싱) 종류 >
전장 유전체 분석
엑솜 분석
타겟 패널 분석
생물안전연구시설(BL3)
운영 활성화 및 규제개선
Ⅰ. 추진 배경
□ 생물안전연구시설(Biosafety Laboratory)은 인체 및 환경에 위해가능성이 있는 생물 및 병원체의 안전한 실험·개발이 가능한 시설
ㅇ 인체위해 생물안전 3등급 연구시설(BL3*)은 인플루엔자, 결핵 등 위해성이 큰 감염병 대응을 위한 병원체 연구 및 신약개발의 필수 인프라
* 생물안전연구시설은 취급하는 생물·병원체의 위해도에 따라 BL1<BL2<BL3<BL4로 구분
ㅇ 금번 코로나19 팬데믹에서도 치료제·백신 개발 전 과정(바이러스 기전연구→동물실험→환자 검체분석 등)에 걸쳐 인체위해 BL3의 중요성 재확인
* 백신 개발 기업의 임상단계 주요 BL3 시설을 활용한 검체분석 지원 중
□ 이에, 정부는 코로나19 대응 총력 지원의 일환으로 인체위해 BL3 시설의 확충과 기존 시설의 민간 지원 적극 추진(‘20.5월~)
ㅇ 과기정통부는 기존 출연(연) 시설을 활용, 치료제·백신 후보물질 약효분석 및 동물실험 지원 중(277개社, 1,715건 지원)
ㅇ 질병관리청은 치료제·백신 개발 지원을 위해 산·학·연이 BL3 시설을 우선적으로 활용토록 연계 프로그램 운영 중(40건 중 24건 연계 완료)
□ 그러나, 향후에도 인체위해 BL3 시설에 대한 현 수준의 정책적 관심 및 투자가 지속되기는 어려울 것으로 예상
ㅇ BL3 시설 특성상 감염병 유행과 연동된 수요의 가변성이 크고, 구축 및 유지관리에 지속적인 비용*이 소요되어 재정 부담 초래
* 실험실2~3실 기준 : (구축비용) 40~42억원 / (운영비) 8~9억원 내외
ㅇ 평상시에는 대부분의 시설이 자체연구 또는 계약에 따른 공동‧위탁연구로 운영됨에 따라 현 수준의 개방성*이 장기화되기는 어려움
* 코로나19 상황 下 (기업‧연구자)수요 제출→(정부)예산 지원→(BL3 운영기관)최우선 제공
☞ 국가 필수 인프라로서 BL3 시설의 중장기적 운영체계를 구축하여 향후 발생 가능한 신변종 감염병에 선제적‧효과적으로 대응
Ⅱ. 현황 및 애로사항
1
생물안전연구시설 현황
□ (구분) 인체‧환경에 대한 위해 가능성이 있는 유전자변형생물체, 고위험 병원체 등의 개발‧실험 등이 가능한 시설로 1~4등급으로 구분
ㅇ 생물안전3등급 시설(BL3)부터는 질병청(인체위해)·과기정통부(환경위해)로부터 허가를 받아 설치, 3년 주기로 재확인 필요
※ (관련법) 유전자변형생물체의 국가간 이동에 관한 법률, 감염병 예방 및 관리에 관한 법률
< 생물안전등급 연구시설 구분 기준 >
구분
등급
인체위해·고위험병원체
(질병청)
환경위해
(과기정통부)
설치·운영
1등급
감염 시 질병 유발 X
위해성 X
신고
2등급
발병해도 치료가 용이
위해가 경미
3등급
증세 심각, 치료 가능
위해가 상당
허가
4등급
증세 치명적, 치료 어려움
위해가 막대
□ (현황) 56개 기관에서 75개 인체위해 BL3 시설 운영 중(‘21.4 기준, [붙임])
ㅇ 현재 코로나19 대응을 위해 정부에서 기업에게 제공 중인 시설은 27개소(질병관리청, 출연(연), 파스퇴르(연) 등)이나,
- 평상시 산·학·연의 연구 수행을 위해 활용될 수 있는 시설은 18개로 현재 구축 중인 시설* 포함하면 20여개로 확대 예상
* 바이러스 연구자원센터(과기부, 12실), 공공백신개발지원센터(질병청, 12실), KAIST 등
< 목적별‧용도별 BL3 시설 현황(개소) >
목적별
용도별
검역‧조사 등*
의료 진단
연구**
합계
일반(BL3)
46
4
9
59
동물(ABL3)
3
3
8
14
대량배양(LBL3)
1
0
1
2
합계
50
7
18
75
* 보건환경연구원, 동물위생시험소, 식약처, 질병관리청, 국방과학연구소 등
** 대학(서울‧고려‧건국대 등 11개소), 연구기관(생명(연), 파스퇴르(연), 화학(연) 등)
2
애로사항
□ (연구시설 개방성 부족) 팬데믹으로 감염병 연구가 폭발적 증가하였으나 실제 일반연구자가 활용 가능한 외부 개방 인체위해 BL3시설은 부족
※ (BL3 관련 연구자 설문조사) BL3 활용이 어려운 이유로 ①BL3의 양적부족(31.3%), ②외부 개방 시설 부족(19.2%)이 가장 높게 나타남
ㅇ 또한, 동‧식물 감염병의 빈번한 발생으로 국가적 피해가 심각*하고, 관련 연구가 증가**하므로 동‧식물 감염병 연구지원 BL3가 필요
* 동물감염병 살처분 3.7조원 규모(’10~’19), 식물감염병 등으로 약 1.5조원/년 피해 추산(’19)
**동물감염병 연구비 2,901억(’14~’18), 예타 진행중(3,700억원, 과기부, 농식품부 공동)
□ (정보 제한) 고위험병원체를 취급하는 인체위해 BL3 시설은 국가 보안시설로 운영 현황 등 민간 연구자가 접근 가능한 정보가 매우 제한적
< BL3 연구시설 관련 현장의 목소리 >
‣ (A제약사) 네트워크가 없는 중소제약사는 BL3시설에 대한 정보를 얻기가 쉽지 않고 BL3시설 활용의 높은 경쟁률로 인해 관련 연구수행 기회가 매우 부족
‣ (B연구자) 코로나 상황과 같이 부족한 BL3시설 지원을 위해 국가가 BL3시설을 지정하여 민간 연구수요를 매칭해주고, 일정 운영비를 부담하는 전략 필요
ㅇ 現 BL3 민간활용 지원은 한시적인 것으로 지속적 지원을 위해서는 연구시설 및 자원 현황을 공유할 수 있는 민-관 협력 체계 필요
□ (제도적 한계) 인체위해 BL3시설의 안전성 확보 외에, 국가 위기상황에 대응 및 원활한 연구수행을 위한 유연성 확보도 중요한 요소
ㅇ 코로나19 연구를 위한 BL3 실험을 진행 중인 경우에도 BL3시설 재확인(3년주기, 질병청)으로 실험 및 시설 운영을 중단해야하는 사례 발생
ㅇ 감염병 연구소재(바이러스, 검체 등)의 취급 뿐 아니라 활용(R&D)의 주체를 BL3 운영기관에 한정되어 일반 연구기관의 역할 제한
◇ 코로나19 팬데믹 상황에서 구축된 BL3 등 연구시설을 연구수요에 대응하여 중장기적으로 안정적, 효율적 활용이 가능하도록
⇨ 구축, 운영, 제도, 추진체계 등에 대한 대안 마련이 필요
Ⅲ. 중점 추진과제
1
(구축) 수요자 중심의 개방형 연구시설 확대
◇ 팬데믹 상황에서 구축된 시설을 고려, 추가구축은 철저한 수요분석에 기반
◇급증하는 신‧변종 감염병 바이러스 연구수요에 대응하기 위하여 BL3의 개방성 확대(안전관리 운영체계 마련 후 시범사업 추진)
□ (신설 방향) 국가 전체의 BL3 활용수요를 조사하고 산‧학‧연 보유 시설의 공급량, 개방도, 안전성 분석 등을 통해 신규 구축방향을 결정
ㅇ 연구시설을 사용하고자 하는 연구계, 산업계 등의 수요조사(과기부)를 실시하고, 안전체계가 포함된 중장기 구축계획 검토(과기부, 질병청)
□ (개방형 BL3) BL3 시설을 개방하여 민간 연구자의 요청에 따라 연구서비스를 제공하는 ‘개방형 BL3’ 시범 운영
ㅇ 외부연구자 연구활동 시 고려해야 할 안전사고 예방, 보안절차 등 운영체계 마련 구축(질병청)
* 질병청 공공백신개발지원센터에서 민간 신청을 받아 위탁 및 공동연구 수행(’21.5월~)
ㅇ 협약을 맺은 기업‧대학과 함께 전체 수요를 바이러스기초(연)이 1차적으로 대응하되, 심화된 실험은 출연(연) 등*으로 연계(2차)(과기부)
* 화학(연), 생명(연)(마우스, 패럿, 영장류 등), KMPC(마우스) 등
ㅇ BL3 시설 활용 전문인력을 배치하여 실험진행 방향, 방법 등을 결정하고 수요자 맞춤형 서비스(세가지 유형)*를 제공(질병청, 과기부)
* ①개방형 BL3에서 위탁 실험, ②전문인력이 동행하여 실험, ③수요자 직접 실험
□ (동‧식물 BL3) 구제역, 과수화상병 등 국가 경제적 손실을 야기하는 동‧식물 감염병 연구수행을 지원하는 공동활용 환경위해 BL3시설 확대
ㅇ 검‧방역 목적 외에 일반 연구자의 동‧식물 감염병 연구수요 증가에 대응하기 위해 신규 구축중인 시설을 중심으로 BL3 공동활용 추진
* 농축산검역본부(동물(완공 ’23)), 식물(완공 ’24)), 농진청(식물(완공 ’24)) 구축 중
2
(운영) 연구시설 간 연계를 통한 운영 효율화
◇ 민간 연구자들의 접근성 제고 및 단일창구 제공을 위한 원스탑(One-Stop) 지원 시스템 구축
◇ 연구기관 간 유기적 연계를 통해 연구수요에 효율적으로 대응하는 ‘연구 인프라 협의체’ 운영
□ (원스탑 지원 시스템) 旣 운영 공동활용 서비스의 이용통로*를 통합하고 이용 편의성 제고를 위한 서비스 개선
* 연구개발지원협의체(과기부), BL3 민간활용 지원 프로그램(질병청) 등
ㅇ PC, 모바일 등을 통하여 가용시설 정보 제공 및 사용신청 접수‧매칭 등을 지원하는 원스탑(One-stop) 서비스 신규 개설(’21.下, 과기부)
ㅇ 단, 위해도가 높은 국가 보안시설임을 감안하여 사용자 인증체계를 마련하고, 인증‧승인된 사용자에 한하여 서비스를 제공(질병청, 과기부)
※ 사용자 보안 수준별 접근 정보, 이용범위 및 절차 등 기준 마련
□ (BL3 운영기관 협의체) BL3 보유 기관이 참여하는 협의체 운영하고 연구시설·자원현황 공유 및 위기상황에 신속하게 대응(질병청, 과기부)
* BL3 시설의 설치‧운영기준, 검증기준 등 제도 개선의견 수렴 창구 마련
□ (연구기관 간 협력) 바이러스기초(연)을 중심으로 출연(연), 대학 등이 참여하는 ‘연구 인프라 협의체’를 구성하고 민간수요에 적극 대응
ㅇ ‘연구 인프라 협의체’ 소속된 기관 중 자체연구 뿐 아니라 일정수준의 개방성을 유지하는 기관에 대하여 인센티브* 부여 검토(과기부)
* 대학 등 운영비 지원이 없는 기관을 중심으로 인센티브 차등 부여방안 검토
3
(제도) 연구시설 활용 활성화를 위한 제도 개선
◇ 연구시설의 최소 요건인 안전성 확보 전제 하에 효율적 활용과 원활한 운영을 위한 관련 제도를 정비
□ (규정 정비) 연구시설 가동이 중단(최소 60일)되는 재확인(3년주기)제도 완화 및 연구시설 활용 확대 위한 관련 규정* 합리화(질병청)
* 유전자변형생물체법 통합고시, 고위험병원체 취급시설 및 안전관리에 관한 고시
ㅇ 현재 BL3 보유기관 요청 시 행정문서를 근거로 운영 중인 재확인 시기 연장(6개월~1년)을 관련 고시 개정을 통해 제도화
ㅇ 장기적으로는 재확인 주기, 검증항목 등 관련 연구를 통하여 개선(안)을 마련하여 안전을 담보로 효율적 운영이 가능한 운영 방안 도출
* 장비 등 일부 항목은 매년 점검하고, 현장 점검만으로는 확인이 어려운 시설과 생물안전 설비영역에 대해서만 3년 재확인을 통해 확인하는 방식 등을 고려
□ (연구자원 활용) 개방형 연구시설 활용 활성화 및 신속한 연구수행을 위하여 고위험병원체, 유전자변형생물체 등에 대한 취급 규정* 유연화(질병청)
* BL3 등 안전관리기준을 충족하는 연구시설을 가진 자만이 취급‧활용이 가능(감염병예방법 제23조, 유전자변형생물체법 제22조의2, 병원체자원법 제14조)
ㅇ 개방형 연구시설과 협약을 맺은 기업‧대학의 경우, 연구자원을 분양받을 수 있는 주체로 인정하고 연구를 수행하도록 규정의 개정을 검토
※ 대전 바이오메디컬 규제자유특구에서 기업이 개방형 연구시설을 통해 연구를 수행하는 시범사업 추진중(’21~’22년, 총 243.5억원, 대전TP·충남대·을지대·건양대 등 참여)
ㅇ 연구용 병원성 연구자원의 분양 제한 완화, 실험승인 절차 간소화*
* 위해도가 낮아 널리 활용되는 연구용 연구자원의 경우 작성항목 축소, 심사기간 단축 등
□ (교육 강화) 민간 참여 연구자의 현장 이해도 제고 및 직접연구 수행 지원 위해 실습 교육시설 구축 및 현장형 교육 프로그램 제공(과기부, 질병청)
ㅇ 생물안전관리자교육(의무, 질병청) 외에 개별 현장에서 직접 BL3 활용 연구 시 도움을 줄 수 있는 현장형 심화교육 기회 제공
4
(추진체계) 국가적 활용을 위한 협력 강화
◇ BL3 시설 확충 및 활용 활성화를 위해 수요자-보유기관-정책입안자가 참여하는 민-관 협력 추진체계를 구축
◇ 향후 신‧변종 감염병 발생 시, 신속한 연구개발 지원을 위해 ‘BL3 등 국가 연구시설 위기대응 매뉴얼’ 마련
□ (BL3 민-관 협의체) 기업‧대학‧학회와 연구 인프라 협의체, 관계부처로 구성하고 국가적인 차원에서 수요 파악 및 효과적 대응
ㅇ 연구시설 추가 구축, 노후시설 고도화, 제도 개선사항에 대하여 논의하고 추진방향 결정
ㅇ 기업‧대학‧학회 등 민간 수요자도 참여하여 연구시설 활용에 대한 애로사항을 상시적으로 청취하고 개선 ⇨ BL3 민-관 협의체 운영
< BL3 민-관 협의체 구성 >
□ (위기대응 매뉴얼) 과기정통부, 질병관리청 중심으로 위기대응 프로토콜을 마련하고 운영기관 및 연구 수요자 대상 공유 및 홍보
ㅇ 감염병 발생 시 바이러스 등 연구자원의 확보‧제공, 연구시설 개방 등과 관련된 대응절차와 조치사항*을 규정
* BL3 운영기관별 역할분담, 상황발생 수준별 조치사항, 상황전파 및 관리체계 등
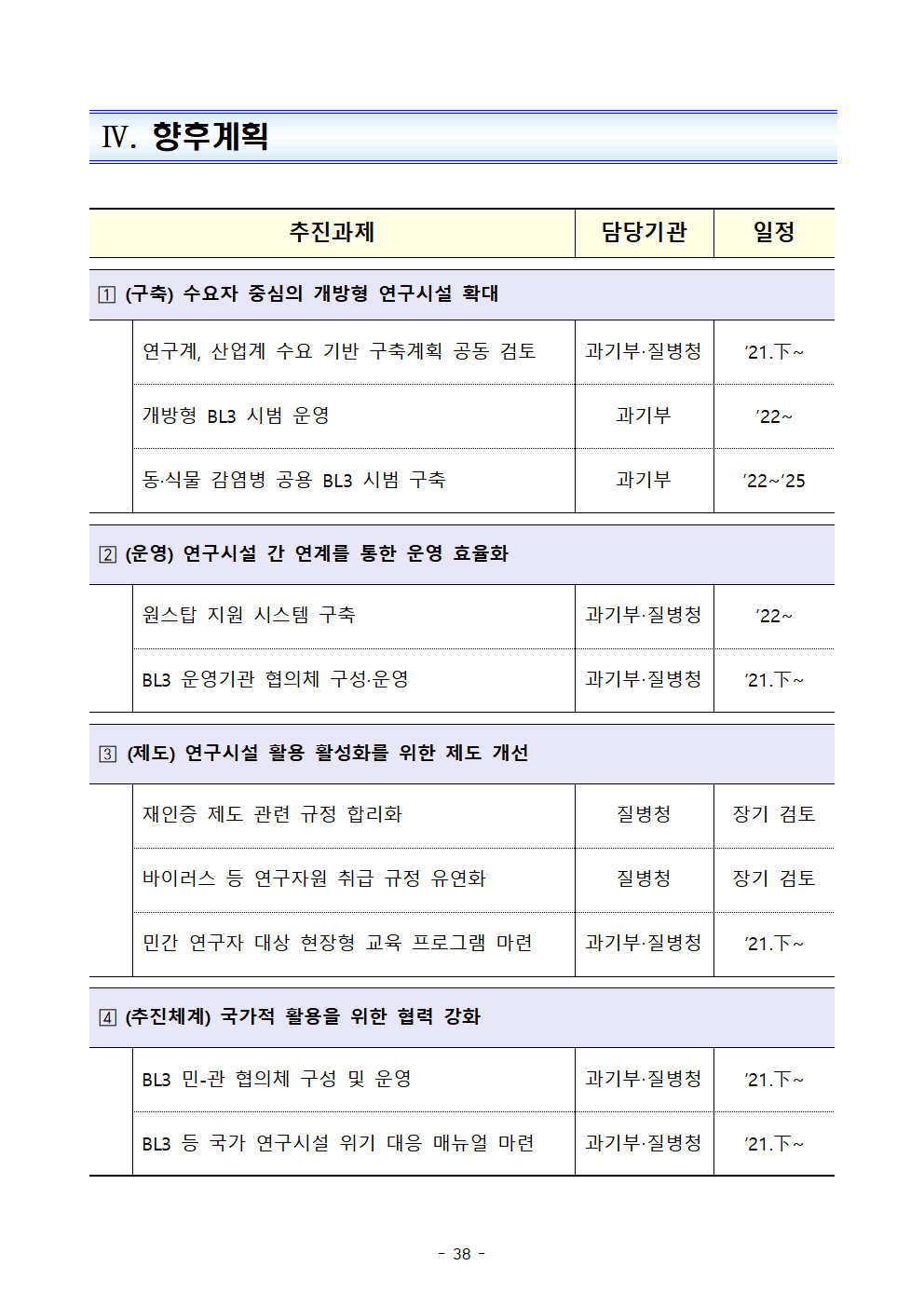
Ⅳ. 향후계획
추진과제
담당기관
일정
?(구축) 수요자 중심의 개방형 연구시설 확대
연구계, 산업계 수요 기반 구축계획 공동 검토
과기부‧질병청
’21.下~
개방형 BL3 시범 운영
과기부
’22~
동·식물 감염병 공용 BL3 시범 구축
과기부
’22~’25
? (운영) 연구시설 간 연계를 통한 운영 효율화
원스탑 지원 시스템 구축
과기부‧질병청
’22~
BL3 운영기관 협의체 구성·운영
과기부‧질병청
’21.下~
? (제도) 연구시설 활용 활성화를 위한 제도 개선
재인증 제도 관련 규정 합리화
질병청
장기 검토
바이러스 등 연구자원 취급 규정 유연화
질병청
장기 검토
민간 연구자 대상 현장형 교육 프로그램 마련
과기부‧질병청
’21.下~
? (추진체계) 국가적 활용을 위한 협력 강화
BL3 민-관 협의체 구성 및 운영
과기부‧질병청
’21.下~
BL3 등 국가 연구시설 위기 대응 매뉴얼 마련
과기부‧질병청
’21.下~
혁신성장 BIG3 추진회의
21-10(공개)
바이오산업 경쟁력 제고를 위한
지식재산 정책지원 추진방안
2021. 5. 26.
특 허 청
Ⅰ. 현황 및 지원 필요성
□ 주요국은 지식재산 제도 정비를 통해 바이오산업 지원中, 우리도 지식재산과 연계한 지원 전략 필요
ㅇ 美·유럽·日·中 등 주요국은 바이오산업 신시장 선점을 위하여 국가 전략 산업으로 선정해 투자를 확대하고 지식재산 제도 정비
[ 주요국 바이오산업 정책 지원 내용 ]
•NIH(국립보건원)은 바이오의료 분야 혁신기술 사업화를 위해 중소기업 지원(’19, 11.4억$)
•대학·연구소 바이오 R&D 상용화·창업지원 위한 ‘Bio Industrie 2021‘(‘06~‘21) 수립, 총 2천억원 창업지원
•‘바이오전략 2019’에서 ’30년 최첨단 바이오경제사회 실현 위한 9개 과제中 ‘지식재산·유전자원 확보’과제 제시
•2021.6.1. 시행 예정인 개정 ‘특허법’ 주요 특징 중 하나가 의약 특허의 보호 강화
ㅇ 우리나라 바이오R&D 투자규모는 지속 확대*되었으나, 세계시장 점유율은 1~2% 수준이고 바이오 국가경쟁력이 낮아 혁신이 요구됨
* 정부 바이오R&D 투자규모: (’14) 2.9조 → (’16) 3.3조 → (’18) 3.5조
** 국가경쟁력순위: (’09)15위→(’13)24위→(’18)26위(美Scientific America World View)
□ 규제개선, 빅데이터 활용으로 바이오 신기술 분야의 지식재산 급증
ㅇ 최근 10년간(’07~’16) 글로벌 특허출원 증가율(10.5%)이 全산업 평균(5.9%) 대비 높고, 시장성장률(5~6%) 보다 높아 특허선점 경쟁이 치열
* 우리나라의 특허출원 점유율(5∼8%)은 美·中·日에 이어 세계 4위권 수준
- 빅데이터 기술과 결합한 디지털 헬스케어 출원은 스마트 진단기술 등 발전으로 증가(美 ’10 1건→’18 296건, 韓 ’10 11건→’18 22건)
ㅇ 바이오산업 육성·규제개선 정책 등에 따라 특허출원이 급증하는 경향
[ 바이오산업 육성정책과 특허출원 상관관계 분석 ]
▸미국: 네거티브 규제에 따라 차세대 유전자 해독기술(NGS) 실용화(‘10) → 유전체분석 특허출원 급증((‘10) 81건→(‘17) 403건)
▸중국: 유전자 분석규정 대대적 정비 등 산업육성정책 발표(’14) → 유전체분석 특허출원 급증((‘14) 78건→(‘17) 245건)
□ 바이오산업은 다른 산업에 비해 철저한 지식재산 확보·보호가 중요
ㅇ 바이오산업은 소수의 특허로도 제품화가 가능하고 막대한 수익창출*·시장독점**이 가능
* (美) 유전자 재조합 기술 특허로 2억5천만$ 로열티 창출, 단백질 치료제 60개 이상 개발
** 세계 판매1위 고지혈증치료제 특허 ’07년 만료, 광학이성질체 등 후속특허로 ’16년까지 연장
ㅇ 바이오 관련 특허분쟁은 분쟁 가능성*이 높을 뿐만 아니라, 분쟁에 따른 손해배상 규모도 천문학적
▸(美) 최근 20년('98~'17) 특허분쟁 비중 : 소비재(16%), 바이오/제약(15%), 컴퓨터/전자(12%)
▸동 기간 배상액 상위 10개 중 4개가 바이오제약(길리어드 25.4억불, 애보트 16.7억불)
[ 바이오 분야 / IT 분야 비교 ]
바이오 분야 IT 분야
R&D 유형 긴 시간, 높은 투자비, 낮은 성공확률 짧은 시간, 낮은 투자비, 개량발명 용이
기술특징 소수 특허로 제품 및 시장 독점 다수 특허, 복합적 기술군에 의한 제품화
모방용이성 높음 상대적으로 낮음
특허 의존도 높음 낮음
라이프사이클 장기적(만료 시까지 존속특허비율 높음) 단기적(소멸특허 비율 높음)
특허의 가치 매우 높음 상대적 낮음(특허포트폴리오, 특허풀 구축 중요)
기술분쟁 개별 분쟁의 영향이 상대적으로 큼 개별 분쟁의 영향이 상대적으로 작음
특허전략 에버그리닝 전략, 리서치툴 특허 특허덤불, 표준특허 등
▣ 인력·장비 등 우수한 인프라*를 토대로 혁신적 바이오산업 발전 유도를 위해 효율적인 지식재산 지원정책 추진 필요
* 분야별 국가경쟁력: 인프라 1위, IP보호 27위, 집중도(특허출원 등 포함) 24위
◇ (R&D) 많은 비용·시간이 투입되는 바이오R&D 특성상 개발단계부터 특허분쟁 예방을 위해 특허 종류·권리기간 등 분석·사전 대응 지원
◇ (데이터) 바이오 R&D의 기초가 되는 생물유전자원 등 바이오 데이터 통합관리·연계를 통해 데이터 활용 강화
◇ (보호) 코로나19 진단장비, 바이오시밀러 등 바이오산업 해외진출에 따라 중소·벤처기업 등의 취약한 국내·외 특허분쟁 대응방안 마련
Ⅱ. 비전 및 추진전략
【 비 전 】
바이오산업의 지식재산 경쟁력 강화
【 정책 목표 】
◇ 바이오분야 지식재산 데이터댐 구축 ◇ 바이오산업 맞춤형 기술보호
◇ 바이오산업 핵심특허 창출 확대 ◇ 인력·제도 등 인프라 확충
추진 전략 핵심 과제
1 바이오 지식재산 바이오 분야 지식재산 데이터댐 구축
데이터 활용 강화
특허데이터-R&D 연계·활용 확대
2 바이오산업 심사기준 개정을 통해 바이오 신기술 권리화 지원
지식재산 창출·
권리화 지원 바이오 신기술 우선심사로 신속한 권리화 유도
지식재산 기반 바이오 R&D 지원 강화
해외 특허출원·권리화 지원 확대
3 바이오산업 지식재산 보호·분쟁 바이오산업 맞춤형 기술보호·분쟁 전략 제공
대응체계 구축
바이오산업 기술침해·인력유출 기반 마련
수출기업의 해외 지재권 분쟁 대응기반 강화
4 바이오산업 지식재산 바이오산업 전문인력의 지식재산 역량 강화
인프라 구축
바이오산업 지식재산 창출·활용을 위한 제도 개선
Ⅲ. 바이오산업 지식재산 정책지원 추진방안
1 바이오 지식재산 데이터 활용 강화
? 바이오 분야 지식재산 데이터댐 구축
ㅇ [필요성] 신약개발 등 바이오 원천기술개발의 핵심도구로 활용되는 고부가가치 생물자원의 확보·활용 역량이 기술경쟁력을 좌우
- 주요국은 생물자원을 고부가 바이오산업 창출을 위한 핵심분야로 인식·관리
•생명연구자원 관리를 위해 국가생물정보센터(NCBI)를 통해 핵심 DB 구축
•회원국간 공동협력을 통해 유럽생명정보연구소(EBI), 유럽생물자원센터네트워크(EBRCN) 등 생명연구자원 및 정보 네트워크 구축
•국가생물자원프로젝트(NBRP)를 통한 생명연구자원 종합관리 체제를 정비하여, 국가빅데이터센터(NBDC)를 설치하고 자원DB를 통합·관리
•‘중의약사업발전125계획’을 통해 베이징게놈연구소(BGI), 국립유전자은행(CNGB) 등 유전체 자원 확보를 위해 대규모 정부 지원
ㅇ [특허생물자원 통합관리] 유전자·세균·종자 등 우수한 생물자원 확보·관리·활용 통합정보 DB 구축으로 종합관리체계 마련
- (통합DB) 특허청 및 4개 기탁기관*에 산재되어 있는 특허미생물 기탁, 출원, 분양정보**를 연계하여 통합DB 구축
* 한국생명공학연구원, 한국미생물보존센터, 한국세포주연구재단, 농촌진흥청
** 총 14,757건 기탁, 2,782건 분양(’20년 기준)
- (해외자원) 국외기탁기관(44개기관, ’20년기준)에 기탁되고 국내출원된 특허미생물에 대한 정보를 수집하여 통합 DB에 반영
- (정보공개) 생물자원업무 관련자*가 특허출원·연구개발 등에 활용할 수 있도록 특허생물자원 통합정보를 실시간으로 제공
* 기탁자(기관), 출원인, 분양신청자, 산·학·연 연구자 등
제공정보 기탁 정보 IP 정보 분양 정보
기탁기관·번호·일자, 미생물의 과학적 성질, 분류학상 위치 등 출원·공개번호, 출원인, 발명인, 발명의 명칭, 청구범위, 요약 등 분양신청인, 분양신청이유,
분양 후 활용 등
- (제도개선) 기탁기관간 실시간 기탁·분양정보 공유로 기탁·출원·분양 절차 및 불필요한 서류 제출 폐지·서식 간소화
? 특허데이터-R&D 연계·활용 확대
ㅇ [필요성] 특허·발명자·기업정보 등 분석을 통해 유망기술 도출 뿐만 아니라 공동 R&D, M&A 등 R&D 전략 지원
* 특허출원동향·피인용률 등 분석을 통해 유망기술 도출, 출원별 발명자정보 등 분석을 통해 우수인력과 공동 R&D, 기업별 특허정보 등 분석을 통해 M&A 전략 수립 가능
ㅇ [특허빅데이터 분석] 특허 분석을 통해 국가 차원의 R&D 유망기술 도출, 국제 공동 R&D 등 오픈 이노베이션 R&D 전략 수립 지원
* (’19) 바이오헬스 → (’21) 디지털 헬스케어 → (’22, 예정) 백신, 진단기술 등
[ 특허빅데이터 기반 산업혁신 전략 수립 절차 ]
절차 ? 환경분석 ➡ ? 정량진단 ➡ ? 심층분석 ➡ ? 정책제안
내용 ▪산업 기술분류 → ▪기술분야별 특허 동향 분석·진단 → ▪유망기술 세부분류 → ▪정부 R&D・산업・인력 등 종합정책
▪시장·R&D·산업 동향·전망 조사 ▪위기신호 탐지 ▪세부기술별 특허맵 구축 및 이슈발굴 ▪기업별 투자전략
부상기술 분석 유망기술 도출 R&D 전략과제 선정 유망산업 육성 전략
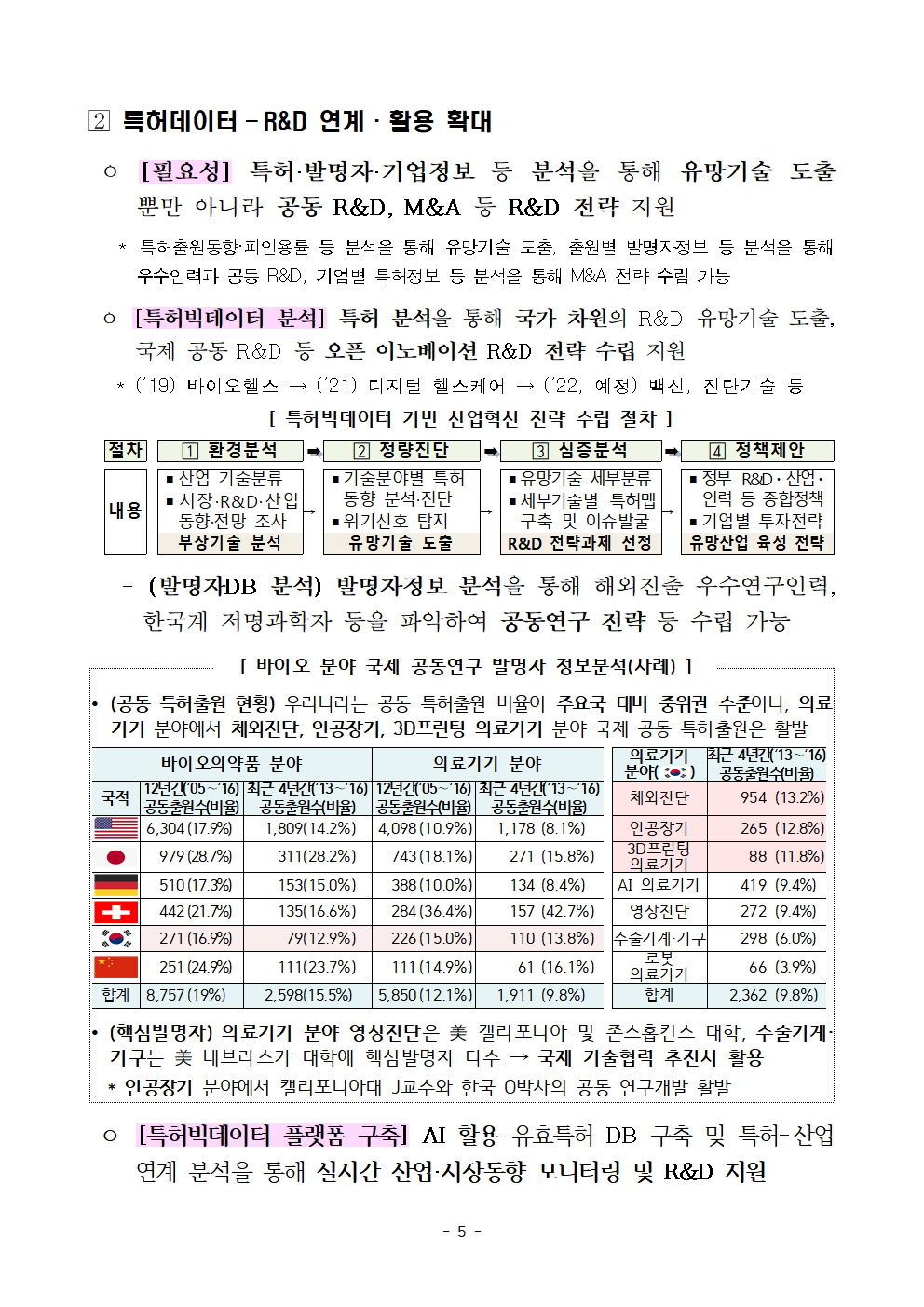
- (발명자DB 분석) 발명자정보 분석을 통해 해외진출 우수연구인력, 한국계 저명과학자 등을 파악하여 공동연구 전략 등 수립 가능
[ 바이오 분야 국제 공동연구 발명자 정보분석(사례) ]
• (공동 특허출원 현황) 우리나라는 공동 특허출원 비율이 주요국 대비 중위권 수준이나, 의료기기 분야에서 체외진단, 인공장기, 3D프린팅 의료기기 분야 국제 공동 특허출원은 활발
바이오의약품 분야 의료기기 분야 의료기기 분야( 최근 4년간(‘13∼‘16) 공동출원수(비율)
)
국적 12년간(‘05∼‘16) 공동출원수(비율) 최근 4년간(‘13∼‘16) 공동출원수(비율) 12년간(‘05∼‘16) 공동출원수(비율) 최근 4년간(‘13∼‘16) 공동출원수(비율) 체외진단 954 -13.20%
6,304 -17.90% 1,809 -14.20% 4,098 -10.90% 1,178 -8.10% 인공장기 265 -12.80%
979 -28.70% 311 -28.20% 743 -18.10% 271 -15.80% 3D프린팅 의료기기 88 -11.80%
510 -17.30% 153 -15.00% 388 -10.00% 134 -8.40% AI 의료기기 419 -9.40%
442 -21.70% 135 -16.60% 284 -36.40% 157 -42.70% 영상진단 272 -9.40%
271 -16.90% 79 -12.90% 226 -15.00% 110 -13.80% 수술기계·기구 298 -6.00%
251 -24.90% 111 -23.70% 111 -14.90% 61 -16.10% 로봇 의료기기 66 -3.90%
합계 8,757 -19% 2,598 -15.50% 5,850 -12.10% 1,911 -9.80% 합계 2,362 -9.80%
• (핵심발명자) 의료기기 분야 영상진단은 美 캘리포니아 및 존스홉킨스 대학, 수술기계·기구는 美 네브라스카 대학에 핵심발명자 다수 → 국제 기술협력 추진시 활용
* 인공장기 분야에서 캘리포니아대 J교수와 한국 O박사의 공동 연구개발 활발
ㅇ [특허빅데이터 플랫폼 구축] AI 활용 유효특허 DB 구축 및 특허-산업 연계 분석을 통해 실시간 산업·시장동향 모니터링 및 R&D 지원
2 바이오산업 지식재산 창출·권리화 지원
? 심사기준 개정을 통해 바이오 신기술 권리화 지원
ㅇ [필요성] 바이오 분야 신기술 및 융·복합 기술 출원 동향*에 따라 구체적 사례를 반영한 심사기준을 수립하여 기술을 권리화·보호할 필요
* (AI+헬스케어 출원) ’10 9건→’19 218건 / (빅데이터+헬스케어 출원) ’10 11건→’19 37건
ㅇ [심사기준] AI 활용 진단·신약개발, 바이오 빅데이터 분석, 바이오베터*, 유전체 등 신기술 관련 심사기준 명확화
* 기존 바이오 의약품의 효능이나 투여 횟수를 개선한 개량신약
바이오 신기술 관련 심사 쟁점
ㅇ (AI 활용) AI를 진단, 신약개발 등에 활용하는 경우 인간의 노력, 창작적 기여 인정에 관한 기준
ㅇ (빅데이터) 바이오마커나 신약후보 탐색시 데이터의 신뢰성 및 발명의 효과 입증 기준
ㅇ (바이오베터) 약리효과의 입증 등에 대한 기준의 명확화로 개량신약의 경쟁력 제고
ㅇ (유전체) 자연물인 유전체 자체의 특허허여 기준 및 이용·개량에 관한 발명 기재요건
- 바이오 분야 신기술 적용 사례*를 지속 발굴하여 심사사례집 발간
* 바이오헬스케어 진단, 생물정보학 빅데이터 분석, 유전자가위, 마이크로바이옴 등
? 바이오 신기술 우선심사로 신속한 권리화 유도
ㅇ [현황] 바이오·헬스케어 분야*에 대해 특허 우선심사를 적극 적용하여 심사처리기간* 단축 지원中(’19.6.~)
* 혁신신약, 맞춤형 헬스케어, AI 또는 3D프린팅을 활용한 의료기기
** 일반심사(14.1개월) v. 우선심사(2.1개월) ⇒ 약 12개월 단축(’19.12. 기준)
ㅇ [우선심사 대상 확대] 진단키트·K-워크스루 등 코로나19 의료방역 물품, 재난대응 제품 관련 출원을 우선심사 대상으로 추가(’21.下)
추가 대상 •감염병예방법에 따라 질병관리청장이 지정한 의료·방역 물품
•재난안전법에 따라 행정안전부장관이 재난안전제품으로 인증한 제품
•긴급한 재난 상황에 대응하기 위하여 특허청장이 지정한 대상
? 지식재산 기반 바이오 R&D 지원 강화
ㅇ [필요성] 국내 바이오기업 88.3%가 300명 미만 중소기업이며, 지식재산 전담인력 확보가 어려운 50명 미만 기업도 62.2%로 IP 연계 R&D에 한계
* 기업규모 비율: 1~49명 62.2%, 50~299명 26.1%, 300~999명 8.0%, 1,000명 이상 3.6%
ㅇ [특허전담관 파견] 바이오분야 창업회사·R&D사업단에 특허전담관(CPO, 특허경영전문가) 파견* 등 지식재산 연계 R&D사업 지원 확대
* ’20 SU신기술창업주식회사 → ’21 범부처전주기의료기기연구개발사업단
ㅇ [가이드라인] R&D 수행시 단계별·기술별 필수적 특허분석내용·절차 등을 안내하는 특허빅데이터 활용 가이드라인 마련·제공
* R&D 기획·연구자 등을 대상으로 특허빅데이터 분석·활용 실무사례를 중심으로 단계별·수준별 교육 프로그램 운영
? 해외 특허출원·권리화 지원 확대
ㅇ [필요성] 바이오산업은 수출 중심 산업*이나, 자본력·정보력이 부족한 중소·벤처기업은 유망 기술을 보유하고도 해외 진출에 한계
* 바이오산업은 50명 미만 기업이 57.1%에 달하지만, 수출액(5조1천억원)이 수입액(1조6천억원)의 3배 이상(’17년 기준, 국내 바이오산업 실태조사 보고서)
ㅇ [해외진출지원] 바이오 유망기술 해외진출을 위한 해외 특허출원·권리화 사업 확대
- 수출 유망 중소기업에 최대 3년간 IP 종합 서비스*를 통해 해외시장 진출을 지원하는 사업 확대
* 해외시장 진출을 위한 특허·디자인 창출전략, 브랜드·디자인 개발, 해외 권리화 등
** 글로벌 IP 스타기업 지원(바이오 분야): (’19) 84개 → (’20) 143개 → (’21) 144개
- 스타트업 대상으로 지식재산 바우처(권리화 비용 지원 등 원하는 지식재산 서비스를 선택·이용)를 확대하여 해외 지재권 확보 비용 지원
* 지식재산 바우처(바이오 분야): (’19) 25개 → (’20) 67개 → (’21.4월) 43개
3 바이오산업 지식재산 보호·분쟁 대응체계 구축
【 바이오산업 지식재산 분쟁 특성 】
◇ 하나의 제품에 여러 유형의 특허가 존재*하고, 다수 기업 대상으로 분쟁 제기
* 신약 하나에 용도, 물질, 제형, 효능 등 약 20개의 특허가 존재
◇ 특허의 가치(로열티)가 다른 산업에 비해 높으므로 분쟁의 규모가 큼
◇ 제품은 특허로 수익을 창출하나, 의약품 제조기술은 영업비밀로 보호
⇨ 바이오산업 특수성을 고려한 맞춤형 지식재산 보호·분쟁 대응 전략 수립
? 바이오산업 맞춤형 기술보호·분쟁 전략 제공
ㅇ [보호전략] 바이오 특허·영업비밀 중 최적의 기술보호를 위한 가이드라인을 수립하여 바이오산업 관련 기업·대학·공공연에 안내
* (특허전략개발원) R&D과제 특허전략 지원시 특허·영업비밀 조합 전략 제공
(영업비밀보호센터) 비밀자료 보관방법 등 체계적 영업비밀 관리방안 지원
모방이 가능한 기술 특허에 의한 보호(공개)
•의료제품 형상·구조 등을 통해 쉽게 분석 또는 유추 가능한 구성·성분 등의 기술 •특허출원(공개되더라도 출원일로부터
20년간 독점·배타적 권리 확보)
모방이 어려운 기술 영업비밀에 의한 보호(비공개)
•의약품 제조요건(온도·압력 등)과 같이 알아내기 어렵고, 비밀로 관리하는 것이 유리한 기술 •영업비밀로 유지 → 타사 기술력이 유사수준에 이른 경우 특허출원 검토
ㅇ [분쟁전략] 해외 분쟁 상황에 따라 공동대응, 무효, 회피 등 필요한 전략을 선택적으로 지원하는 기업 선택형 대응전략 지원 확대
* ‘지재권분쟁 대응센터(’20.11. 설치)’를 통해 분쟁정보 수시 모니터링 및 원스톱 분쟁대응 지원
[ 바이오산업 해외 지재권 분쟁 대응전략 지원 현황 ]
지원년도 바이오의약품 의료기기 헬스케어 합 계
2018 5 32 7 44
2019 4 35 2 41
2020 10 34 5 49
2021.4. 2 12 5 19
[ 의료기기 분야 해외 지재권 분쟁 대응전략 지원(사례) ]
▪ (지원배경) H사의 휴대용 무선 초음파 기기*가 미국 S사로부터 자사의 특허를 침해했다는 내용의 경고장 수령
* 코로나19 폐질환 중등도 검사에 활용
▪ (지원내용) 경고장에 기재된 30건의 특허분석을 통해 비침해 및 무효항변 전략 마련
☞ 라이선스 체결 및 무효자료 확보를 통해 미국에서의 추가 특허소송 진행 가능성을 미연에 방지 → 안정적인 미국 시장 진출 가능
? 바이오산업 기술침해·인력유출 기반 마련
ㅇ [수사조직 강화] 기술침해·인력탈취에 대한 수사·조사 전담체계 구축 및 인력 증원 추진, 장비 확충 등을 통해 수사역량 강화
ㅇ [중장기계획] 범부처 기술보호 체계 구축을 위한 ‘부정경쟁방지‧영업비밀보호 5개년 기본계획*’ 수립
* 인력유출 방지, 기술보호 취약분야(중소기업‧대학‧공공연) 보완, 국가 주요기술 보호 등
** 국가 주요기술 보호방안에 바이오 분야 기술을 포함하여 수립하는 방안 검토
? 수출기업의 해외 지재권 분쟁 대응기반 강화
◦ [IP-DESK] 미국·일본·독일 등 주요국 IP-DESK를 통해 바이오산업 지재권 분쟁 대응역량이 우수한 현지 대리인 발굴, 수출기업 지원에 활용*
* 현지 협력로펌 풀을 구축하여 해외진출 기업 분쟁 예방 및 대응 지원
ㅇ [가이드북] ‘해외 지재권 보호 가이드북’ 개정*을 통해 바이오 등 해외 현지 지재권 분쟁에 적절히 예방·대응할 수 있는 정보 제공
* ’20년말 기준 미국, 유럽, 일본, 중국 등 27개국 가이드북 발간, 매년 3~4개국 개정 추진
4 바이오산업 지식재산 인프라 구축
? 바이오산업 전문인력의 지식재산 역량 강화
ㅇ [필요성] 많은 시간·비용이 투입되는 바이오산업 특성상 산업 全주기 지식재산 관리를 전담하는 전문인력 양성 필요
ㅇ [대학교육] 바이오특화 대학인 충북대를 중심으로 IP 중점대학으로 지정*하여 지식재산 교육 지원**
* (’21) 충북대(바이오), 전남대(미래차), 경상대(제조ICT)/※ 교육부 지역플랫폼 사업 연계
** IP 커리큘럼을 특화하여 특허기반 R&D‧자금확보‧경영 등 IP 전공 학·석·박사 양성
ㅇ [실무인력 양성] 제약·바이오업계 연구인력 지식재산 역량 강화*, 소규모R&D사업단·중소·스타트업 인력양성** 등 지원
* 지재위·바이오협회 협업 제약·바이오업계 IP-R&D 역량 제고를 위한 실무교육
** 석·박사 미취업자, 경력단절여성 전공자 IP실무인력 양성 교육 및 취업 연계
? 바이오산업 지식재산 창출·활용을 위한 제도 개선
ㅇ [의료방법발명] AI를 이용한 진단방법, 로봇에 의한 수술방법 등 신기술과 결합된 의료기술 보호를 위한 법령(특허법) 개정 추진
- 의료방법발명 제도개선은 생명의 존엄성과 관련되어 면밀한 사회적 합의가 필요하므로, 다방면의 의견수렴을 통해 신중히 검토
* 미국, EU, 일본 등 주요국들은 의료방법발명에 대한 특허적격성에 대한 범위를 넓히되, 그 역기능을 억제하는 방향으로 정책 추진中
ㅇ [산업재산권 정보활용법] 바이오 등 산업 분야 산업재산권 정보 활용 촉진을 위한 (가칭)‘산업재산권 정보 분석·활용 촉진법’ 제정
- (주요내용) 산업재산권 정보 수집 및 DB구축, 발명자 DB 등 개인정보(가명) 개방을 위한 법적근거 마련 등
[(가칭)‘산업재산권 정보 분석 및 활용 촉진에 관한 법률’ 주요내용]
구 분 주요 포함 사항
총 칙 •산업재산권 정보의 정의/종류, 산업재산권 정보의 관리‧활용 기본계획 수립
•산업재산권 정보 활용위원회, 정보 수집·가공·활용 촉진을 위한 분석 전문기관 지정‧육성
정보 생산‧구축 •산업재산권 정보 수집, DB 구축‧관리, 해외 정보 입수 및 교환 국제협력
정보 유통‧관리 •산업재산권 정보 제공에 있어 개인정보(가명) 처리, 지능정보기술 기반 시스템 구축‧운영
정보 활용 촉진 •산업재산권 정보 분석을 통한 산업전략 수립 및 R&D 활용, IP서비스업 등 관련산업 육성
Ⅳ. 향후 계획
추 진 과 제 담당부처 일정
? 바이오 지식재산 데이터 활용 강화
특허생물자원 통합관리 특허청 ~’22
특허빅데이터 분석 지원 특허청 ’19~
특허빅데이터 플랫폼 구축 특허청 ~’22
? 바이오산업 지식재산 창출·권리화 지원
심사기준 개정을 통해 바이오 신기술 권리화 지원 특허청 ~’21
바이오 신기술 우선심사로 신속한 권리화 유도 특허청 ’19~
특허전담관 파견 특허청 ’21~
(과기부, 산업부, 복지부, 식약처 등 협조)
특허빅데이터 활용 가이드라인 제공 특허청 ’21~
해외출원 지원 확대 특허청, 지자체 ’19~
? 바이오산업 지식재산 보호·분쟁 대응체계 구축
바이오산업 맞춤형 기술보호·분쟁 전략 제공 특허청 ’21~
기술침해·인력탈취 수사조직 강화 특허청 ~’21
부정경쟁방지·영업비밀보호 5개년 기본계획 수립 특허청 ~’21
IP-DESK 분쟁 대응역량 강화 특허청 ’21~
해외 지재권 보호 가이드북 개정 특허청 ’21~
? 바이오산업 지식재산 인프라 구축
IP 중점대학 지정 특허청 ’21~
지식재산 실무인력 양성 특허청(지재위 협조) ’21~
바이오 지식재산 제도 개선 특허청 ~’21
'판교핫뉴스1' 카테고리의 다른 글
| 제3회「코리아 핀테크 위크 2021」개막- “핀테크와 지속가능한 금융혁신”을 주제로 온‧오프라인 동시개최 (0) | 2021.05.27 |
|---|---|
| 6월 1주차 한국판 뉴딜 주요사업 일정표 (0) | 2021.05.27 |
| 창업고민 온라인으로 해결! 2021 경기 창업허브 스타트업 고민상담소 성료 (0) | 2021.05.27 |
| “카드 들고 다니지 않으셔도 됩니다” 경기지역화폐도 모바일 페이로 결제 시작-‘경기지역화폐 간편결제 서비스’ 6월 1일자로 본격 시행 (0) | 2021.05.27 |
| 경기도, 2021년 경기도 1인 크리에이터 아카데미 ‘입문반 1,2기’ 교육생 모집-1인 크리에이터 입문반 교육생 90명 모집. 취업까지 연계 (0) | 2021.05.27 |
