코로나19 백신 관련 현황[ 2020-12-18]
등록일 : 2020-12-18[최종수정일 : 2020-12-18] 담당부서 : 코로나19치료제·백신개발범정부지원위원회사무국
















코로나19 백신 관련 현황
□ 정부는 12월 18일(금)에 현재 코로나19 백신 확보현황 및 예방접종 계획에 대해 붙임 자료와 같이 설명하였다.
< 붙임 > 1. 코로나19 백신 확보 현황 및 예방접종 계획
붙임 코로나19 백신 확보 현황 및 예방접종 계획(안)
코로나19 백신 확보 현황 및 예방접종 계획(안)
2020. 12. 18.
관계부처 합동
목 차
Ⅰ. 코로나19 백신 확보 추진 경과 및 현황 4
Ⅱ. 코로나19 백신 예방접종 계획(안) 15
백신 확보 추진 경과 및 현황
◈ 범정부지원위원회 및 국무회의를 거쳐 「백신 확보 전략」 발표(12.8)
- 불확실성 등 고려하여 인구60% 이상 접종 가능한 4천4백만명분 확보
◈ 1분기(2~3월)을 시작으로 접종계획을 고려하여 단계적 도입
? 백신 확보 주요 경과
□ 백신개발이 불확실한 상황 속에서 믿을 수 있는 백신을 신속 확보하기 위해 ‘20.7월부터 선구매 협상 추진
ㅇ 화이자, 아스트라제네카, 얀센, 모더나 등과 협상 진행(’20.7월~)
- 아스트라제네카(7.21. CMO계약) 및 노바백스(8.13 CDMO계약) LOI(Letter of Intent) 체결
- 아스트라제네카(8.28, 9.3), 얀센(10.14), 화이자, 모더나(8.28), 머크(8.27), GSK(11.26)와 관계부처 합동회의 실시 이후 주 2~3회 실무차원의 협의 진행
ㅇ 위험 분산을 위해 COVAX Facility를 통한 글로벌 공동구매에도 참여*
* 가입의향서(6.30)․참여의향확인서(8.31) 제출, 구매 약정 체결․선급금 지급(10.9., 850억 원)
** 관계부처 합동회의 3회(8.6, 8.11, 8.25)
□ 이를 위해 관계부처*․민간전문가 등으로 구성된 「백신도입TF」 구성·운영(6.29.~), 범정부 협력 체계 가동(17회)
* 보건복지부, 외교부, 질병관리청, 식품의약품안전처
- 해외 백신개발 동향, COVAX 상황, 예산, 국내 확보방안 등에 대해 검토
☞ 백신 선구매에 대한 높은 불확실성* 하에, 기업별 백신의 안전성·유효성을 입수 가능한 제한된 자료 범위 내에서 최대한 검토
* 아스트라제네카 원인불명 부작용(9.8.), 얀센 이상 사례 발생(10.12) 등
□ 범정부지원위원회(8.21.), 국무회의(9.15.) 거쳐 「백신 확보 기본방향」 발표
ㅇ 1단계로 인구 60%(약 3천만 명) 접종 가능 백신 우선 확보*, 수급 동향, 국내 백신 개발 상황 등을 고려 인구 60% 이상 접종을 위한 2단계 백신 단계적 구매 추진
* (COVAX Facility) 1천만 명분, (개별기업 협상) 2천만 명분
□ 백신 선택 등 전문적 자문을 위해 전문가 자문위원회 구성·운영을 통해 도입방안 등 논의(11.12, 11.16.)
ㅇ 백신 확보는 국민 안심과 경제 활성화를 위해 중요, 글로벌 경쟁 등을 감안하여 신속하게 최대 물량 확보 추진 의견 제시
□ 국무총리 주재 관계부처 장관회의 개최(11.23), 범정부위원회, 국무회의를 거쳐 「백신 확보 전략」 발표(12.8)
ㅇ 성공 불확실성* 등을 감안해 기존 인구 60% 이외 추가로 확보할 수 있는 최대 물량 先 확보 추진 결정
* 대부분 기업 아직 3상 진행 중, 충분한 추적 관찰 기간 없이 출시 → 접종 과정에서 부작용 등 발견 가능성도 고려
- COVAX 및 개별기업을 통해 4.4천만 명분을 확보, 내년 1분기부터 백신 플랫폼별로 순차적으로 도입
ㅇ 백신 도입에 따른 예방접종 체계를 신속하고 차질없이 준비
? 백신 확보 현황
◈ 4.4천만 명분(COVAX 1천만 명 + 개별 기업 3.4천만 명) 확보
□ (COVAX Facility) 1천만 명분(2천만 회분) 신속도입 협상 중
- 1차 공개된 백신 후보에 대한 참여 의사 旣 표명(11월)하였으며, 1월(변동 가능) 중 구체적인 물량과 제공 시기 등 제시 예정
☞ 1분기 내 백신 도입 가능성 및 방안에 대해 COVAX와 협의 추진
□ (개별 기업) 최대 3.4천만 명분(6.4천만 회분) 선급금 지급 통해 우선 확보 추진
ㅇ 아스트라제네카(2천만 회분)는 구매 계약서 체결 완료하였으며, 얀센, 화이자, 모더나와 구매약관 및 공급확인서 등 체결
ㅇ 얀센·화이자는 12월, 모더나는 1월을 목표로 계약 체결 추진
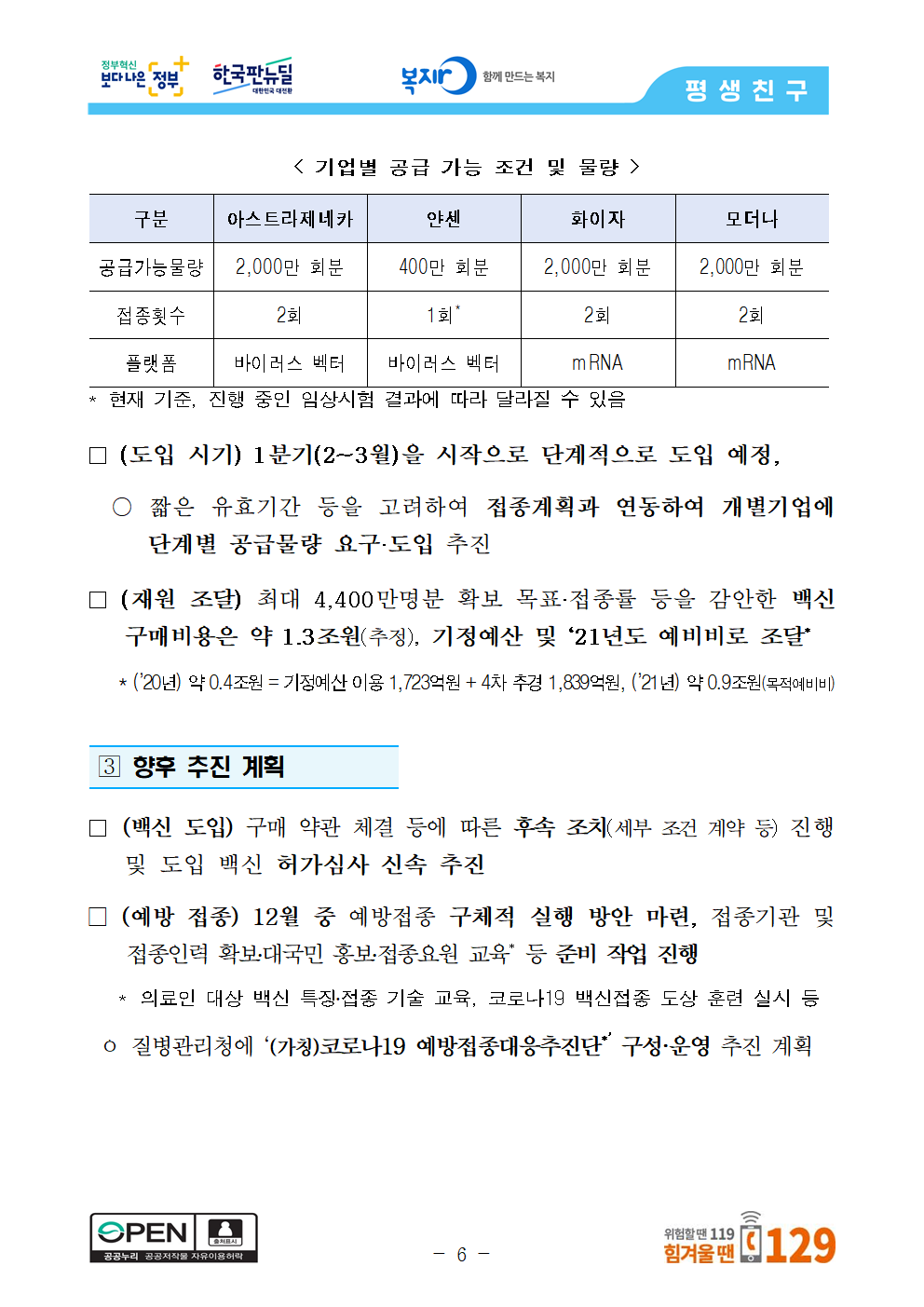
< 기업별 공급 가능 조건 및 물량 >
구분 아스트라제네카 얀센 화이자 모더나
공급가능물량 2,000만 회분 400만 회분 2,000만 회분 2,000만 회분
접종횟수 2회 1회* 2회 2회
플랫폼 바이러스 벡터 바이러스 벡터 mRNA mRNA
* 현재 기준, 진행 중인 임상시험 결과에 따라 달라질 수 있음
□ (도입 시기) 1분기(2~3월)을 시작으로 단계적으로 도입 예정,
○ 짧은 유효기간 등을 고려하여 접종계획과 연동하여 개별기업에 단계별 공급물량 요구·도입 추진
□ (재원 조달) 최대 4,400만명분 확보 목표·접종률 등을 감안한 백신 구매비용은 약 1.3조원(추정), 기정예산 및 ‘21년도 예비비로 조달*
* (’20년) 약 0.4조원 = 기정예산 이용 1,723억원 + 4차 추경 1,839억원, (’21년) 약 0.9조원(목적예비비)
? 향후 추진 계획
□ (백신 도입) 구매 약관 체결 등에 따른 후속 조치(세부 조건 계약 등) 진행 및 도입 백신 허가심사 신속 추진
□ (예방 접종) 12월 중 예방접종 구체적 실행 방안 마련, 접종기관 및 접종인력 확보․대국민 홍보․접종요원 교육* 등 준비 작업 진행
* 의료인 대상 백신 특징․접종 기술 교육, 코로나19 백신접종 도상 훈련 실시 등
ㅇ 질병관리청에 ‘(가칭)코로나19 예방접종대응추진단*’ 구성·운영 추진 계획
참고1 코로나19 백신 확보 관련 FAQ
1. 백신 도입 시기는 언제이며, 구체적인 계획은?
□ 백신은 ’21년 2~3월부터 순차적으로 도입할 예정
○ 백신 공급 시점은 제약사별 생산량, 계약시점 등에 따라 차이가 있으며, 분기별로 물량을 나누어 순차적으로 들여올 계획임
○ 다만, 도입 일정은 짧은 유효기간이나 까다로운 보관 조건 등을 감안하여 접종 계획과 일정 등을 고려하여 결정할 계획임
* Covax Facility 참여 백신에 대한 도입 시기는 별도로 정해질 예정임
□ 국가 간 백신확보 경쟁, 공급시기에 따른 국가간 형평성 등의 사유로 기업들의 비공개 요청에 따라, 구체적인 공급시기·일정은 공개가 어려움
2. 백신 도입이 너무 늦은건 아닌지?
□ 백신 개발 완료 전에 유효성이나 안전성이 입증되지 않은 백신을 불가피하게 선구매해야 하는 등 불확실성이 높은 상황에서 구매 협상을 진행
ㅇ 아스트라제네카*, 얀센** 등 심각한 부작용으로 인한 임상시험 중단사태 등을 감안해 국민 건강을 최우선으로 고려하여 협상을 진행해 왔음
* 원인불명 부작용(횡단성척수염, 영국 1명)으로 임상 자체 잠정 중단(9.8)하였으나, 안전성 검토 후 영국 임상(9.12), 미국 임상 재개(10.23)
** 3상 임상시험 진행중 예상하지 못한 심각한 이상사례 발생으로 임상시험 일시중단(10.12) 되었으나, 안전성 검토 후 임상 재개
○ 계약 이후에도 최대한 공급 시기를 앞당기는 노력도 지속 추진
3. 외국은 전 인구의 몇 배수로 백신을 확보하고 있는데, 우리 정부는 너무 적게 확보하는 것 아닌지?
□ 당초 집단면역 형성을 위한 인구 60%수준인 3천만 명분보다 확대하여, 4천 4백만 명분의 백신을 확보하였음
○ 확보한 백신*은 성공 가능성이 높은 백신이므로 집단면역을 형성하는데에 부족하지는 않을 것으로 판단
* COVAX(2천만회분), 바이러스 벡터 백신(아스트라제네카 – 2천만회 분, 얀센 – 400만 회분), mRNA 백신(모더나- 2천만회분, 화이자 – 2천만회분)
□ 그럼에도 불구하고 후발 백신 개발 기업의 우수한 백신 개발 현황 등을 모니터링하여 추가적인 물량 확보를 위해 노력하겠음
4. 미국 행정 명령*으로 인해 한국으로의 백신 공급 차질 여부?
* 자국에서 개발되었거나 미국 정부가 조달한 코로나19 백신에 대해 자국민의 백신 접근성을 우선 보장(12.8)
□ 글로벌 제약사 확인 결과, 현재 공급 물량 변경 계획은 없으며, 대부분의 기업이 미국 외의 지역에서 백신을 생산하고 있음
○ 특히, 아스트라제네카 초도물량은 한국 SK바이오사이언스에서 위탁 생산 물량을 공급받을 예정임
○ 향후 행정 명령 영향에 대해서는 지속적으로 모니터링할 계획
5. 백신 구매를 위한 예산은 충분히 확보되어 있나?
□ 선급금 및 백신 구매비가 예산으로 편성되었으며, 추가적인 물량 구입비 및 예방접종비 등은 추가적으로 예산을 확보해 나가겠습니다.
6. 실제로 확보한 건 아스트라제네카 하나에 불과한 거 아닌지?
□ 여러 기업 중 아스트라제네카社 백신개발이 가장 앞섰으며, 이에 따라 절차적으로 협상이 먼저 시작되어 계약이 빨리 이루어진 것임
○ 다른 기업과도 구매약관 및 공급확인서를 체결하였으며, 이는 계약을 체결하기 위한 일련의 과정에 있는 절차로 계약에 준하는 효력이 있음
○ 화이자 및 얀센은 12월, 모더나는 내년 1월 계약 체결을 목표로 기업들과 협의를 진행하고 있음
7. 코로나19 백신 효과는?
ㅇ 현재 개발 중인 백신은 짧은 개발 기간*, 충분한 추적 관찰 기간 없이 출시되는 것 지금까지 발표된 자료로 정확한 효능을 판단하기 한계가 있음
* 통상 임상시험 소요기간은 1상 1.6년, 2상 2.9년, 3상 3.8년 등 약 8.3년 소요(식약처)
- 백신별로 임상 조건 등이 상이해 실제 효능은 백신별·연령별 임상 유효성 결과, 허가 범위 등을 종합적으로 고려 필요
※ 3상 임상시험 최종결과는 화이자는 95%(11.18.), 모더나 94.1%(11.30.), 아스트라제네카 중간결과평균 70%(11.23.)의 예방효과를 발표하였음
8. 아스트라제네카 FDA 승인이 연내 어렵다는데, 위험한 거 아닌지?
○ 영국, 유럽 등에서도 아스트라제네카에 대한 롤링 리뷰가 진행 중이며, 「란셋(The Lancet)」지 동료평가*를 통해서도 안전성이 확인됨
* “23,848명, 3개월간 추적관찰 결과 3명만 부작용(백신과 관련성이 확인 안됨)이 발생하였으며, 모두 회복하거나 회복중에 있어 아스트라제네카 백신의 안전성이 확인됨”
○ 아울러, 아스트라제네카 백신의 경우 전세계적으로 가장 많은 물량이 선구매 및 선진국에서도 상당 물량 선구매한 것*으로 추정
* 미국(3억 도즈), 영국(1억도즈), 일본(1.2억 도즈)
9. 아스트라제네카 벡신의 미FDA 승인이 연내 어렵다고 하는데, 우리나라 식약처 승인도 어려운 건지?
○ 임상시험 및 품질자료 등과 함께 미국, 유럽 등 제외국 승인현황을 종합하고, 안전성 검증을 철저히 하면서 신속하게 심사해서 질병청 예방접종 계획에 차질이 없도록 최선을 다 하겠음
- 유럽과 영국에서는 허가를 위한 사전검토가 진행중
- 참고로, 최근 美 정부 백신개발 프로젝트 책임자(몬세프 슬라위)는 언론 인터뷰*에서 아스트라제네카 백신은 내년 2월 긴급사용승인 예정이라 발표한 바 있음
* 美 언론, FOX NEWS (12.13)
10. 아스트라제네카 백신은 임상시험 중 절반용량을 1회차 접종한 것이 더 효과가 높고, 예방 효과가 62~90%, 화이자는 95%, 모더나는 94.1%인데, 아스트라제네카 백신을 맞아도 효과가 있는 것인지 ?
□ WHO 제시한 코로나19 백신의 예방효과 기준은 50% 이상임
○ 모든 백신이 100% 예방효과를 보이는 것은 아니며, 인플루엔자(감기) 백신의 일반적인 유효율은 약 70% 정도임
○ WHO에서 제시한 코로나19 백신의 예방효과는 50% 이상으로 3개 백신의 결과 모두 이를 상회함
* (근거) WHO, 긴급사용을 위한 코로나19 백신 평가 고려사항(’20.9)
○ 다만, 화이자 및 모더나 예방효과는 최종분석 결과이지만,
○ 아스트라제네카 백신의 예방효과 70%는 3상 중간 분석 결과이며 아직 3상 임상시험을 진행 중이므로, 임상시험이 완료된 후 최종 결과 등을 면밀하게 검토할 예정임
11. 국내 코로나 백신 개발 현황은?
○ SK바이오사이언스는 ‘21년 말 국내 개발 완료를 목표로 추진 중임.
- (자체 개발) 재조합 백신 후보물질 활용, 백신 개발 중, 10월 임상 1/2상 신청, 내년말까지 임상 완료 목표
- (공동개발) Bill & Melinda Gates Foundation, 빌게이츠 재단 글로벌 협력社들과 공동으로 백신 개발 진행 중(’20년내 임상1/2상 신청 추진)
* SK바이오사이언스, CEPI(전염병대비혁신연합)로부터 1,000만달러 연구개발비 지원받음(12.9., 한국경제)
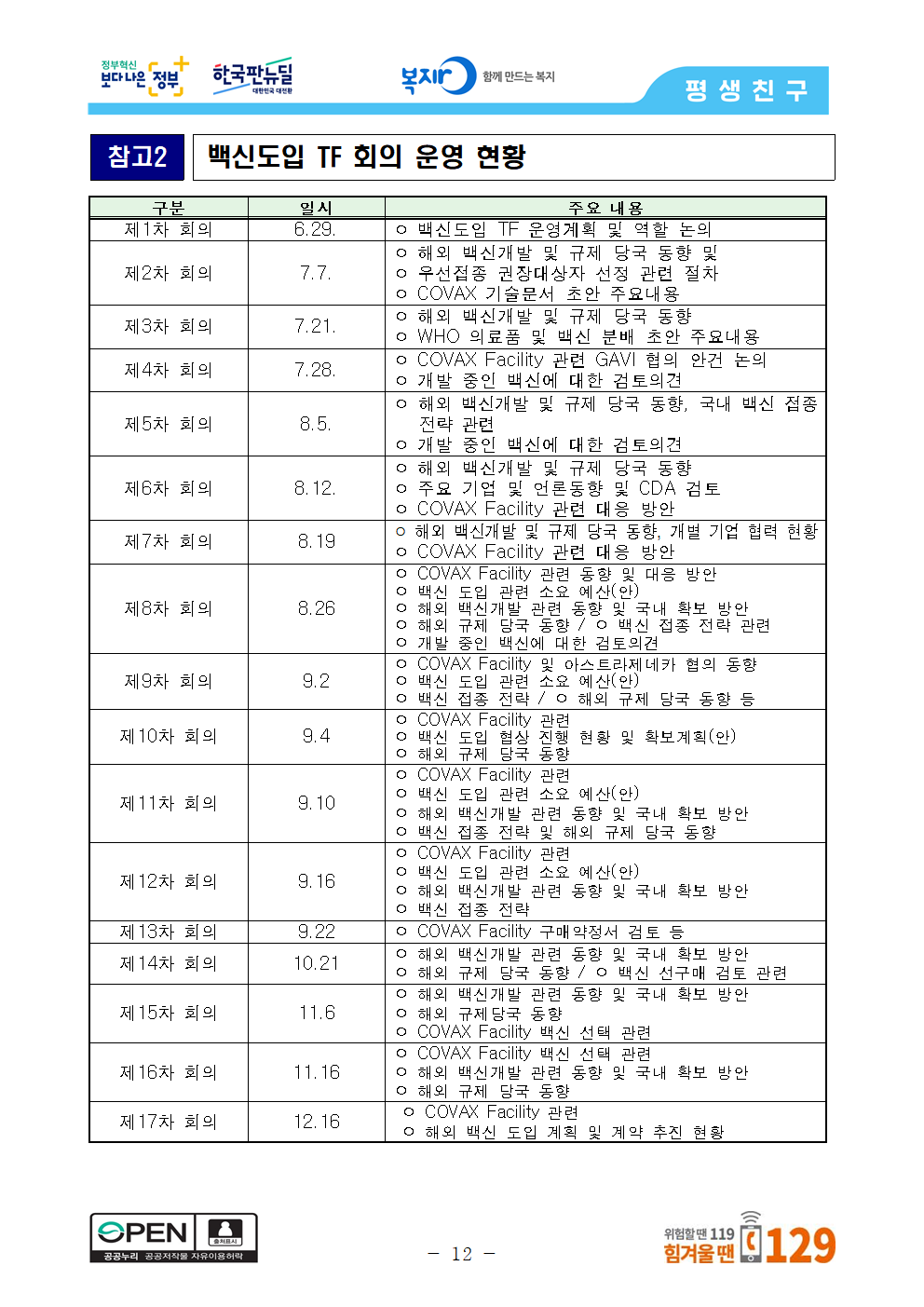
참고2 백신도입 TF 회의 운영 현황
구분 일시 주요 내용
제1차 회의 6.29. ㅇ 백신도입 TF 운영계획 및 역할 논의
제2차 회의 7.7. ㅇ 해외 백신개발 및 규제 당국 동향 및
ㅇ 우선접종 권장대상자 선정 관련 절차
ㅇ COVAX 기술문서 초안 주요내용
제3차 회의 7.21. ㅇ 해외 백신개발 및 규제 당국 동향
ㅇ WHO 의료품 및 백신 분배 초안 주요내용
제4차 회의 7.28. ㅇ COVAX Facility 관련 GAVI 협의 안건 논의
ㅇ 개발 중인 백신에 대한 검토의견
제5차 회의 8.5. ㅇ 해외 백신개발 및 규제 당국 동향, 국내 백신 접종 전략 관련
ㅇ 개발 중인 백신에 대한 검토의견
제6차 회의 8.12. ㅇ 해외 백신개발 및 규제 당국 동향
ㅇ 주요 기업 및 언론동향 및 CDA 검토
ㅇ COVAX Facility 관련 대응 방안
제7차 회의 8.19 ㅇ 해외 백신개발 및 규제 당국 동향, 개별 기업 협력 현황
ㅇ COVAX Facility 관련 대응 방안
제8차 회의 8.26 ㅇ COVAX Facility 관련 동향 및 대응 방안
ㅇ 백신 도입 관련 소요 예산(안)
ㅇ 해외 백신개발 관련 동향 및 국내 확보 방안
ㅇ 해외 규제 당국 동향 / ㅇ 백신 접종 전략 관련
ㅇ 개발 중인 백신에 대한 검토의견
제9차 회의 9.2 ㅇ COVAX Facility 및 아스트라제네카 협의 동향
ㅇ 백신 도입 관련 소요 예산(안)
ㅇ 백신 접종 전략 / ㅇ 해외 규제 당국 동향 등
제10차 회의 9.4 ㅇ COVAX Facility 관련
ㅇ 백신 도입 협상 진행 현황 및 확보계획(안)
ㅇ 해외 규제 당국 동향
제11차 회의 9.1 ㅇ COVAX Facility 관련
ㅇ 백신 도입 관련 소요 예산(안)
ㅇ 해외 백신개발 관련 동향 및 국내 확보 방안
ㅇ 백신 접종 전략 및 해외 규제 당국 동향
제12차 회의 9.16 ㅇ COVAX Facility 관련
ㅇ 백신 도입 관련 소요 예산(안)
ㅇ 해외 백신개발 관련 동향 및 국내 확보 방안
ㅇ 백신 접종 전략
제13차 회의 9.22 ㅇ COVAX Facility 구매약정서 검토 등
제14차 회의 10.21 ㅇ 해외 백신개발 관련 동향 및 국내 확보 방안
ㅇ 해외 규제 당국 동향 / ㅇ 백신 선구매 검토 관련
제15차 회의 11.6 ㅇ 해외 백신개발 관련 동향 및 국내 확보 방안
ㅇ 해외 규제당국 동향
ㅇ COVAX Facility 백신 선택 관련
제16차 회의 11.16 ㅇ COVAX Facility 백신 선택 관련
ㅇ 해외 백신개발 관련 동향 및 국내 확보 방안
ㅇ 해외 규제 당국 동향
제17차 회의 12.16 ㅇ COVAX Facility 관련
ㅇ 해외 백신 도입 계획 및 계약 추진 현황
참고3 해외백신 부작용 관련 언론사 보도 요약
◈ 해외개발 백신의 사용승인(英, MHRA, 美 FDA)에 따라 주요국은 순차적으로 접종을 진행중으로 관련 부작용 보도사례를 정리
< 참고 > 해외 코로나19 백신 승인 현황
❖ 화이자(3상 임상결과 예방효과 95%) : 英(12.2.), 캐나다(12.9.), 사우디(12.10.), 美 FDA(12.11.)/CDC(12.12.) 등 승인 → 英(12.8.~), 美·캐나다 접종 시작(12.14.~) , * EU EMA(12.1.) 긴급사용승인 신청
❖ 모더나(3상 임상결과 예방효과 94.1%) : 미국 FDA(11.30.), 유럽 EMA(11.30.), 싱가포르(12.1.) 긴급사용승인 신청 → 美 FDA, 12.17. 이후 승인 예정
❖ 아스트라제네카(3상 임상 중간결과 평균 예방효과 70.4%), * 예방효과(1차→2차 투여량): 90%(1/2→1) vs. 62.1%(1→1)
□ 화이자(바이오엔텍) 백신 부작용 사례 보도
ㅇ (WP, 연합뉴스 등, 12.8.) “英, 접종 첫날 백신 맞은 뒤 2명 알레르기 반응·치료”
* (주요내용) 심각한 반응을 보이는 이유를 과학자들도 정확히 파악하지 못한다고 보도 심각한 알레르기 반응전력 있는 사람 임상제외, 따라서 알레르기 반응 없다고 보도
※ 美 CDC는 他 백신에 알레르기 반응 있으면 접종 前 전문가와 상담 권고
※ 英 HNS, MHRA은 과거 약품, 음식, 백신 알레르기 반응 있을시 백신 접종 금지
ㅇ (파이낸셜뉴스. 12.10.) “‘안면마비’까지...코로나 백신 부작용 우려 폭증”
* 세계 최초로 백신접종을 시작한 영국에선 하루만에 2건의 부작용 보고. 미국내 대규모 임상에서 안면신경 마비 사례 발생(2만 1,720명중 3명), 위약그룹은 未 발생
ㅇ (한국경제 12.11.) “안면마비 등 부작용 영국*이어 미국**서도 보고”
* (주요내용) 영국에서 「아나필락시스(생체 과민 반응)」 사례 2건과 일반 알레르기 반응추정 1건 보고. 현재 회복 중
** 미국 임상에서도 구안외사(안면신경마비)사례 일부 발생(2만1,720명중 4명)
※ 면역반응이 원인이 돼 발생하는 급격한 전신 과민 반응, 특정음식이나 약물 등 화학물질의 영향으로 과도한 면역반응이 일어나 급성 호흡곤란, 혈압저하, 의식소실 등 심각한 부작용이 나타날 수 있음
ㅇ (NYT, 연합, YTN, SBS 등, 12.17.) “美, 알래스카 의료요원, 백신 맞은 뒤 과민증 병원 입원”
* (주요내용) 알레스카州 의료종사자 화이자 백신 맞은 뒤 알레르기 반응(홍조, 숨가쁨) 사례 발생 → 병원입원·응급조치 → 퇴원후 현재 상태 관찰중(他 알레르기 반응여부 조사중)
※ 화이자 백신 일부 임상시험 참가자 통증이나 발열 등 부작용 발생 보고 → 美 CDC는 의료진에게 백신접종 후 20-30분간 이상 여부 관찰토록 권고
ㅇ (CNBC, 12.15.) “美 FDA, 모더나, 화이자 임상실험과정에서 접종 후, 안면근육실조(Bell’s Palsy) 증상발생 보고, 접종 후 집중관리 지시”
* (주요내용) FDA는 임상실험과정에서 모더나, 화이자 백신 접종 후 4건의 안면근육실조(안면마비증상) 현상 발생을 검토 보고서에 적시
※ FDA는 동 사례를 부작용으로 보지 않으며 백신 때문인지는 데이터 부족으로 판단이 어려우며, 앞으로 지켜 보겠다는 입장
ㅇ (한국경제, 12.17.) “화이자 백신 맞아도 되나...알레르기 반응에 온도 급강하(영하 70℃ → 영하 92℃) 문제도”
* (주요내용) 너무 낮은 온도에서 보관된 백신의 안전여부도 규명되지 않았지만, 일단 문제의 상자에 담긴 백신 수천회 분을 제조사에 반납
□ 모더나 백신 부작용 사례 보도
ㅇ (WSJ, 연합뉴스, 12.17.) “3상 임상 참가자, 2차 접종후 뼈마디 쑤셔”
* (주요내용) 임상시험 참가자들은 1차 접종 무증상이나, 2차 접종 후, 크고 작은 후유증 경험. 다만, 2-3일 경과 후, 증상 사라지고 다른 증상이 없어 접종 권고
※ 사례) 美, A 간호사 2차 접종 후, 오한, 통증, 두통 및 온몸의 관절에 통증 발생, 또 다른 B 간호사도 오한, 발열, 심한 관절 및 근육통 경험
ㅇ (뉴스1, 12.16.) FDA “모더나 백신 부작용, 피로감·두통·근육통 정도“
* (주요내용) 모더나백신 부작용중은 피로감·두통·근육통이 가장 흔했으며 메스꺼움·구토·얼굴붓기 등도 드물게 보고됨. 10명중 9명은 주사 맞은 주위에 통증, 7명은 피로감, 6명은 두통이나 근육통 경험
※ 사례) 임상참가자 3만여명중 4명은 얼굴 반쪽이 아래로 처지는 부작용이 있었음. 2회 투여분때 부작용 나타날 확률이 더 높았음
□ 아스트라제네카 백신 부작용 사례 보도
ㅇ (NYT, 12.8.) “7월, 9월 영국과 브라질에서 임상환자에게 횡단성척수염 의심 증상 발생으로 임상중단 했는데, 아스트라제네카는 백신과 부작용이 관계없다는 증거 FDA 제출했다고 해명”
* “임상중단 사실과 이유를 투명하게 알리지 않아 FDA 신뢰를 잃었다고” 보도
코로나19 백신 예방접종 계획(안)
예방접종 개요
□ (계획수립) 12월 중 예방접종 구체적인 실행 방안 마련, 이후 접종기관 및 접종인력 확보․대국민 홍보․접종요원 교육* 등 준비 작업 진행
* 의료인 대상 백신 특징ㆍ접종 기술 교육, 코로나19 백신접종 도상 훈련 실시 등
□ (목표) ① 보건의료체계 및 국가의 필수 기능 유지, ② 이환률 및 사망률 감소, ③ 지역사회 내 전파 감소
□ (방법) 국가적 위기 상황임을 감안하여 임시예방접종* 지정하여 시행
* 관련근거: 「감염병의 예방 및 관리에 관한 법률 제24조, 25조」
□ (접종시기) 최초 도입(2~3월) 후 신속히 접종 시행되도록 철저히 준비
ㅇ ▴공급 물량 ▴코로나19 국내 상황 ▴외국 접종 상황 및 부작용 여부 ▴국민 수요 등 고려하여 대상자, 세부 일정 등은 탄력적으로 조정, 인플루엔자 유행시기(11월) 전 완료 목표
□ (접종기관) 백신 유통, 보관 방법, 접종방식 등 백신의 특성을 고려하여 접종기관을 구분하여 실시
ㅇ (mRNA백신) -70℃의 엄격한 냉동보관, 백신 전처리 등이 가능한 접종기관 확보, 철저한 사전 준비를 통해 접종 필요
ㅇ (바이러스전달체백신) 기존 보관ㆍ유통 경로로 접종가능, 의료기관 신청을 받아 백신보관 등에 대한 사전 점검 후, 지정하여 접종
접종 대상자
□ (대상) ▴연령(고령), ▴집단시설 거주, ▴만성질환, ▴의료 등 사회필수서비스 인력 등을 고려하여 우선접종 권장 대상* 중심으로 접종
* 의료기관 종사자, 집단시설 생활자 및 종사자, 노인, 성인 만성 질환자(19∼64세, 중등도 이상 위험), 소아청소년 교육ㆍ보육시설 종사자 및 직원, 코로나19 1차 대응요원, 경찰ㆍ소방 공무원ㆍ군인 등 검토 중
ㅇ 백신·플랫폼별 공급량 및 특성, 안전성과 유효성, 부작용 발생 사례 등을 고려하여 백신별 접종 대상자, 접종기관 등 지정 예정
ㅇ 백신공급 시점에서의 역학적 상황, 백신 공급 물량, 백신별 임상결과(대상자 포함 여부) 등에 따라 우선순위 변동 가능
ㅇ 외국의 접종사례 등을 면밀히 모니터링하여 접종계획에 반영
백신 공급·유통
□ (유통·공급) 백신 통관, 출하 승인, 분배, 배송, 보관 및 콜드체인 모니터링 등 백신 유통·공급 관리체계 구축
ㅇ (초저온 냉동 백신) 제조·수입자가 국내 접종장소까지 초저온 유지 배송 예정, 접종기관에 초저온 냉동고를 구비하여 보관·관리 추진
* (보관기간) -80∼-60℃(6개월), 2∼8℃(5일)
ㅇ (냉장 백신) 제조사 측이 국내 일정 장소까지 배송, 별도 유통 계약을 체결한 국내 유통사에서 분배 및 접종기관까지 배송
ㅇ (콜드체인 관리) 초저온 냉동 및 냉장 콜드체인 유지를 유통업체 관리감독, 합동점검·모니터링 등 실시(식약처 협조)
접종 사후관리
□ (부작용 및 이상반응 관리) 알려지지 않은 이상반응 발생 가능성 존재, 질병관리청-식품의약품안전처 공동 감시 모니터링 체계 구축
ㅇ 백신제조사 등으로부터 이상반응 발생 관련 지속적인 정보 수집 및 공유를 통해 부작용·이상반응 신속 대응 및 관리
□ (피해보상) 국가예방접종에 대한 피해보상 규정(감염병예방법 등) 존재, 관계부처 합동 전담조직 구성 및 대응
□ (통합관리전산시스템) 수급관리-접종안내-사전예약-예약자관리-접종 등록-추적관리(이상반응 감시)-통계산출* 등 별도 통합시스템 구축
* 연령, 성별, 지역별, 백신종류, 이상반응 유무 등 모니터링 가능
향후계획
□ 각 백신별 공급시기 및 허가 진행 상황에 따라 공급 후 신속히 접종할 수 있도록 철저히 준비
□ 코로나19 접종센터, 접종 위탁의료기관 지정 및 접종요원 대상 도상 훈련 및 접종 교육 등 준비
□ 통합관리전산시스템 및 접종 후 이상반응 감시체계 구축
□ 코로나19 임시예방접종 지정 및 최종 시행계획 확정
참고1 코로나19 예방접종 계획 관련 FAQ
1. 예방접종 시행 시기는 언제인지? 구체적인 우선접종권장대상자는 누구인지?
□ 백신은 ’21년 2~3월부터 순차적으로 도입함에 따라 각 백신별 도입 후 신속하게 예방접종이 시행 될 수 있도록 철저히 준비할 예정이며,
○ 보건의료체계 1차대응요원 등 우선접종 권장 대상자부터 단계적으로 접종하고, 우선 접종 권장 대상자에 대한 예방접종은 인플루엔자 유행시기 이전(4분기)까지 최대한 마무리 예정임
○ 우선 접종권장 대상자로는 노인, 집단시설 거주, 만성질환 여부 등 코로나19 취약계층과 보건의료인 등 사회 필수서비스 인력 등을 검토 중
2. 백신의 종류가 다양한데, 개인이 접종 백신을 선택할 수 있는지?
□ 코로나19 예방 및 확산 감소를 위해 적정 인구수 이상 접종이 필요하나, 개인의 건강상태 등을 고려하여 본인동의 하에 접종 예정
○ 백신별/플랫폼별 공급량 및 특성, 안전성과 유효성, 부작용 발생 사례 등을 고려(전문가 자문)하여 백신별 접종 대상자, 접종기관 등을 선정할 예정
- 백신종류별 임상조건(접종가능 연령), 효능 및 안전성 등 특성이 달라 전문가 검토 등을 통해 적합한 백신을 접종받을 수 있도록 검토 예정
3. 전국민 대상 접종이 필요한 것은 아닌지?
□ 백신 도입 및 공급, 접종 상황(접종률), 백신 임상 결과*(소아청소년 대상) 등을 고려하여 접종 대상자를 우선접종권장대상자를 우선으로 순차적으로 확대하는 방안을 검토할 예정임
□ 다만, 현재까지 개발 중인 백신 중에는 18세 미만 및 임신부 대상으로는 임상시험 자료가 없어 현재로써는 우선접종권장대상이 아님
○ 향후 18세 미만 등 대상자별 임상시험 진행상황 등을 지속적으로 모니터링하여 접종가능성을 검토할 계획임
4. 최근 독감 백신 부작용 관련 이상반응감시체계를 운영해왔는데, 코로나 백신 부작용에 대한 피해보상을 비롯한 대책은 무엇인지?
□ 알려지지 않은 이상반응 발생 가능성에 대해 질병관리청-식품의약품안전처 공동감시 모니터링 체계를 구축하고,
ㅇ 범정부 협업을 통한 백신과 이상반응 간의 인과성 조사 및 평가와 백신 봉인·접종지속 여부 결정을 위한 신속 대응 및 피해보상 체계를 구축할 예정임
※ (참고) 백신 부작용 등 이상반응에 대한 보상체계
▸ ‘감염병예방법’에 따른 필수예방접종 및 임시예방접종의 국가지원사업(무료접종) 대상자가 예방접종 이상반응으로 피해를 입은 경우 국가가 보상해주는 ‘예방접종피해보상제도’ 운영
▸ 또한, 필수·임시예방접종 이외의 유료 접종 대상자의 경우, 약사법에 따라 중대한 부작용에 대해 국가가 보상해주는 ‘의약품부작용 피해구제 제도’ 운영
5. 백신 보관, 배송·유통, 접종 등에 대한 준비가 잘 갖추어졌는지?
□ 백신의 도입부터 접종 단계까지 안전한 예방접종이 시행될 수 있도록 관계부처 등과 협력하여 철저히 준비할 계획임
○ 백신 유통·보관 단계에서의 콜드체인 유지, 접종기관 및 접종 인력 교육에 관한 사항 등 철저한 사전 준비가 필요하며,
○ 식약처와 질병청이 지속적으로 협력 소통하고, 범부처 협업체계 구축 및 전문가 의견수렴 등을 통해 전반적으로 철저히 준비해 나갈 것임
6. 화이자 -70도 보관 가능한 냉장고와 관련하여, 각국에서 경쟁적으로 구입 중인데, 우리나라 보유 현황 및 구매 진행상황은?
□ 백신 보관 등에 필요한 냉동고 등에 대해서는 국내 생산·제조업체 등을 통해 용량, 규격, 납품 가능 수량 등을 협의하고 있음
7. 보관 조건에 따라 해동하고 희석하는 절차 등 백신 접종 절차가 까다로운 것으로 아는데, 예방접종 인력에 대한 교육은 어떻게 할 건지?
□ 백신 접종 방법 등에 대해서는 제조사별 제품 설명서, 해외 접종 경험사례 등을 토대로 세부적인 예방접종 사업지침을 마련한 후 접종기관 준수사항, 접종 방법에 대해 사전 교육을 진행할 예정임
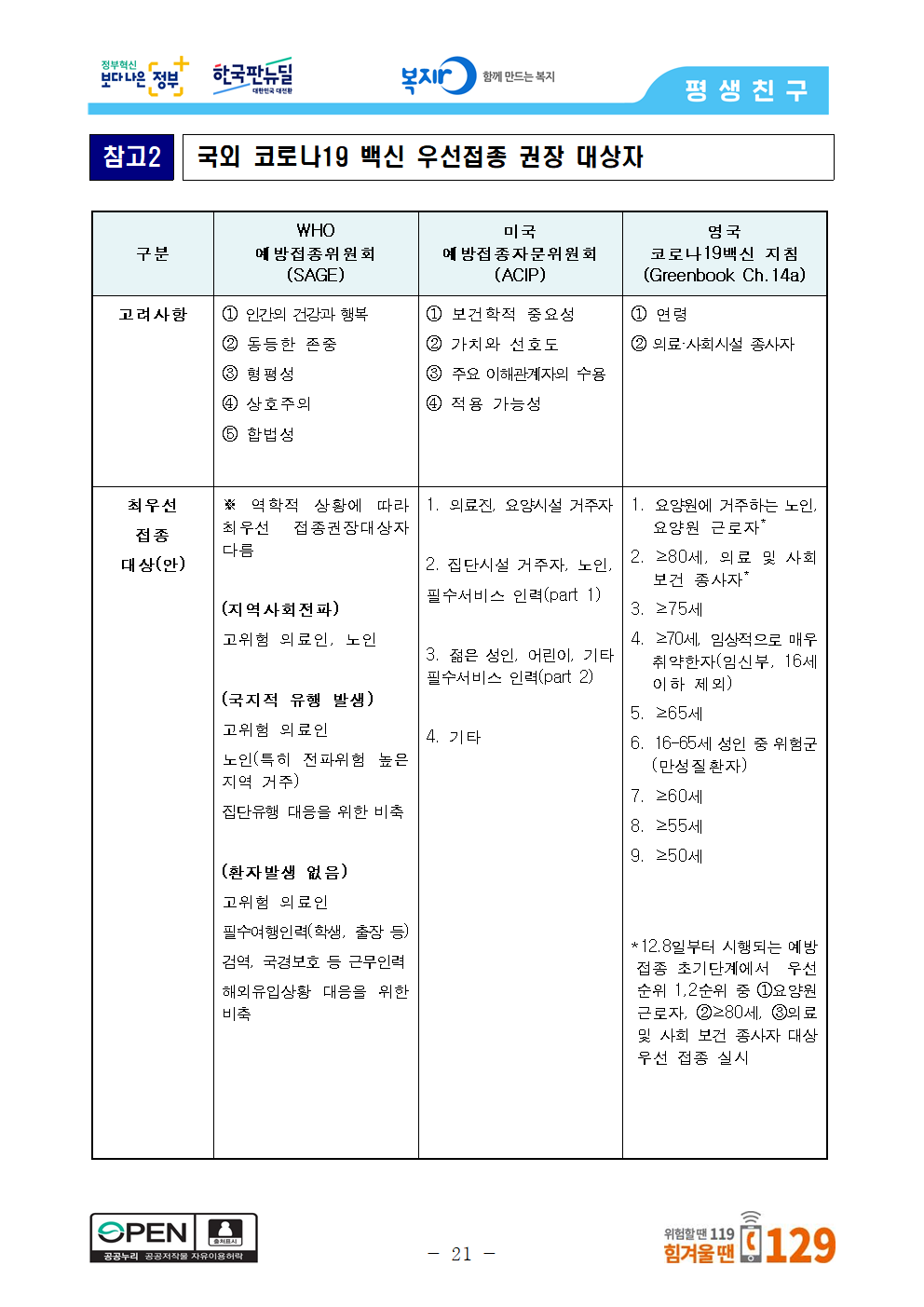
참고2 국외 코로나19 백신 우선접종 권장 대상자
구분 WHO 미국 예방접종자문위원회 영국
예방접종위원회 (ACIP) 코로나19백신 지침
(SAGE) (Greenbook Ch.14a)
고려사항 ① 인간의 건강과 행복 ① 보건학적 중요성 ① 연령
② 동등한 존중 ② 가치와 선호도 ② 의료·사회시설 종사자
③ 형평성 ③ 주요 이해관계자의 수용
④ 상호주의 ④ 적용 가능성
⑤ 합법성
최우선 ※ 역학적 상황에 따라 최우선 접종권장대상자 다름 1. 의료진, 요양시설 거주자 1. 요양원에 거주하는 노인, 요양원 근로자*
접종 2. ≥80세, 의료 및 사회 보건 종사자*
대상(안) (지역사회전파) 2. 집단시설 거주자, 노인, 3. ≥75세
고위험 의료인, 노인 필수서비스 인력(part 1) 4. ≥70세, 임상적으로 매우 취약한자(임신부, 16세 이하 제외)
5. ≥65세
(국지적 유행 발생) 3. 젊은 성인, 어린이, 기타 필수서비스 인력(part 2) 6. 16-65세 성인 중 위험군(만성질환자)
고위험 의료인 7. ≥60세
노인(특히 전파위험 높은 지역 거주) 4. 기타 8. ≥55세
집단유행 대응을 위한 비축 9. ≥50세
(환자발생 없음)
고위험 의료인 *12.8일부터 시행되는 예방접종 초기단계에서 우선순위 1,2순위 중 ①요양원 근로자, ②≥80세, ③의료 및 사회 보건 종사자 대상 우선 접종 실시
필수여행인력(학생, 출장 등)
검역, 국경보호 등 근무인력
해외유입상황 대응을 위한 비축
'판교핫뉴스1' 카테고리의 다른 글
| 2020년 보건의료기술진흥 유공자 정부포상 시상-조직검사 없이 유방암 진단기술 개발, 영예의 훈장 수여 (0) | 2020.12.19 |
|---|---|
| 2020년 보육 유공자 정부포상-공공보육에 35년여 몸담은 어린이집 원장에 훈장 수여 (0) | 2020.12.19 |
| 「모자보건법」시행령 개정안 입법예고-출산 지원 강화를 위한 산후조리도우미 이용 대상 소득 기준 완화 (0) | 2020.12.19 |
| 2020년 상반기 통신자료 및 통신사실확인자료 제공 등 현황 발표 (0) | 2020.12.19 |
| 올해의 데이터‧네트워크‧인공지능(DNA) 우수사례 시상식 개최 (0) | 2020.12.19 |
