건강기능식품 기능성 원료 제품화 기술지원 신청하세요!-식약처, 연구개발부터 기능성 인정까지 원료의 신속 제품화 기술지원 추진
담당부서 | 영양기능연구과/건강기능식품정책과2021-06-10







건강기능식품 기능성 원료 제품화 기술지원 신청하세요!
식약처, 연구개발부터 기능성 인정까지 원료의 신속 제품화 기술지원 추진
□ 식품의약품안전처(처장 김강립) 식품의약품안전평가원은 안전하고 우수한 건강기능식품 기능성 원료가 신속하게 개발되어 기능성을 인정받을 수 있도록 오는 7월부터 원료개발부터 제품화까지 전 주기에 걸친 맞춤형 기술지원을 실시합니다.
○ 이번 기술지원은 건강기능식품 분야 개발자(또는 기업)의 원료 표준화, 안전성‧기능성 시험 등에 대한 이해도를 높여 우수한 식품소재들이 기능성 원료로 개발될 수 있도록 도움을 주기 위해 마련했습니다.
○ 주요 내용은 ▲원료의 표준화(제조공정, 지표성분 설정 및 시험법 등) ▲안전성 평가(섭취량 평가, 독성시험 등) ▲기능성 평가(인체적용시험 등) 등입니다.
□ 이번 기술지원은 업체에서 제출한 연구기술서(붙임 1)를 토대로 원료개발 수준을 분석해 1:1 맞춤형 컨설팅을 진행합니다.
○ 기술 수준 분석은 총 3단계에 걸쳐 추진하며 1단계(연구기획), 2단계(기전연구)는 코로나19 상황을 감안해 영상회의와 유선상담을 하고, 3단계(인체적용시험 설계 등)는 모둠토의 등 대면 상담으로 진행합니다.
* ▲(1단계) 연구기획(소재탐색, 지표물질 선정, 표준화 등) ▲(2단계) 기전연구(시험관, 동물실험) ▲(3단계) 인체적용시험 설계, 인정‧신청 준비
○ 또한 국가별 수출 절차와 인허가‧통관절차 등 해외동향을 안내하고 해외건강기능 식품 관련 법령 번역본 등도 제공합니다.
○ 지원사업에 참여를 희망하는 업체는 6월 30일까지 영양기능연구과(ffmfds@korea.kr) 또는 한국건강기능식품협회(khsa_info@naver.com)로 신청하면 됩니다.
기술지원사업 신청 방법
✓ (접수일정) 2021. 6. 10.(목) 9:00 ~ 2021. 6.30.(금) 18:00
✓ (접수방법) 영양기능연구과 : 팩스(043-719-4420), 이메일(ffmfds@korea.kr)
- 한국건강기능식품협회 : 팩스(031-628-2349), 이메일(khsa_info@naver.com)
✓ (제출자료) 보도자료 첨부 파일(기술상담 신청서, 연구기술서 및 요약서)
✓ (기타문의) 식품의약품안전평가원 영양기능연구과(043-719-4430)
□ 식약처는 이번 기술지원이 건강기능식품 업체의 기능성 원료 제품화에 도움이 될 것으로 기대하며, 앞으로도 국민 건강증진에 도움을 주는 다양한 기능성 제품이 개발될 수 있도록 산업계·협회 등과 협력을 강화할 계획입니다.
○ 아울러, 식약처는 이번 제품화 기술지원이 필요한 업체들의 많은 관심과 참여를 부탁했습니다.
<참고> 2021년 기능성 원료 제품화 기술지원 신청서
붙임 1 `21년 기능성 원료 제품화 기술지원 신청서
식품의약품안전처에서는 한국건강기능식품협회와 협력하여 안전하고 우수한 건강기능식품 기능성 원료가 신속하게 개발·인정될 수 있도록 원료개발 단계부터 제품화까지 전 주기에 걸친 맞춤형 기술지원을 진행하고자 합니다.
제품화 기술지원에 참여를 희망하는 업체는 6월 30일까지 다음의 신청서를 작성하여 영양기능연구과(ffmfds@korea.kr) 또는 한국건강기능식품협회(khsa_info@naver.com)로 신청하시면 됩니다.
회사명 대표자(신청자) (인)
주소 및 연락처
1. 기능성 후보 원료명 :
신청 기능성
구분 제품화 기술지원 분야 상세 기술지원 필요사항 비고
(자사 제품 개발현황 등과 연계하여 작성)
원료 ① 기능(지표)성분 및 제조공정 등에 관한 사항
표준화 ② 기준·규격 및 시험방법 등에 관한 사항
안전성 ③ 의사결정도, 섭취량 평가 등에 관한 사항
④ 독성시험에 관한 자료
기능성 ⑤ 기반연구(시험관 및 동물시험)에 관한 사항
⑥ 인체적용시험에 관한 사항
기타 ⑦ 기능성 원료 인정 신청을 위한 제출 자료 준비에 관한 사항
⑧ 기능성 원료 등 수출에 관한 사항
⑨ 기타 현장 애로사항 등
⑩ 우수 건강기능식품업체 견학 등
※ 기능성 원료 제품화 기술지원사업 목적으로 활용될 예정이며, 제출시 개인정보 수입․이용에 동의하신 것으로 간주 됩니다.
(양식 1) 연구기술서 요약
【기본사항】
기관(회사)명 (대표자: )
주소
담당자 성명 직위
전화 휴대전화
FAX 전자우편
【개발소재】
원료명 이력 예산관련
➀ ooo □상담 □모둠토의 □심사 □정부(기관명: ) □기타( )
➁ □상담 □모둠토의 □심사 □정부(기관명: ) □기타( )
➂ □상담 □모둠토의 □심사 □정부(기관명: ) □기타( )
➃ □상담 □모둠토의 □심사 □정부(기관명: ) □기타( )
【연구단계】
➀ ooo
※ 개발소재별로 각각 작성하여야 합니다.
기준규격 1 1. 원재료 □
단계 2. 제조공정 □ 준비 중 □ 확립 중 □ 확립 완료
3. 기능(지표)성분 □ 분석/문헌확보 □ 설정 □ 분석법 확보 □ 분석 완료
4. 유해물질 □ 유해물질 항목 선정 □ 분석 중 □ 분석 완료
안전성 2 1. 기초 자료 □ 섭취근거자료 □ 섭취량평가자료
단계 □ DB 검색 등을 통한 안전성 정보 자료(부작용 등)
□ 영양평가자료 □ 생물학적 유용성자료 □ 인체시험자료
2. 독성시험자료 □ 자료 확보 □ 설계 중 □ 실시 중 □ 시험 완료
기능성 3. 시험관 시험 □ 자료 확보 □ 설계 중 □ 실시 중 □ 시험 완료
4. 동물시험 □ 자료 확보 □ 설계 중 □ 실시 중 □ 시험 완료
3 5. 인체적용시험 □ 설계 중 □ 실시 중 □ 시험 완료
단계
(양식 2) 연구기술서 상세
➀ ooo
※ 개발소재별로 각각 작성하여야 합니다.
항 목 주요 내용
1. 원재료 ※ 상세자료 별첨가능
(학명: , 사용부위: , 원산지: )
항목 검토여부
유사 원재료와 구분할 수 있는 자료 O/ X
2. 제조공정 ※ 상세자료 별첨가능
∘ 원재료( ) → → → 추출( ) → 농축( ) → → “XX추출물”( )
* 제조과정 상( )에는 기능(지표)성분의 함량을 기재함
항목 검토여부
사용된 원료·첨가물이 건강기능식품의 기준 및 규격, 식품의 기준 및 규격, 식품첨가물의 기준 및 규격에 적합한가? O/ X
주요 제조단계별 기능(지표)성분의 함량변화 O/ X
주요 제조단계별 수율변화 O/ X
4. 기능(지표) 성분
항목 검토여부
기능(지표)성분 설정근거 O/ X
5. 시험방법 ∘공인시험법/자사시험법(밸리데이션 포함) 여부
6. 규격 1) 성상 :
2) 기능(지표)성분(함량 mg/g) :
* 기능(지표)성분 시험법
3) 납(mg/kg) :
4) 총비소(mg/kg) :
5) 카드뮴(mg/kg) :
6) 총수은(mg/kg) :
7) 대장균군 :
8) 유해물질(잔류농약, 곰팡이 독소 등 분석 여부:
1. 기준·규격에 관한 자료
2. 안전성에 관한 자료
항 목 주요 내용
7. 안전성 (1) 의사결정도
(2) 섭취 근거 ※ 상세자료 별첨가능
<인정현황>
◦ 국내 :
◦ 국외 :
<사용/유통현황>
◦ 국내 :
◦ 국외 :
(3) 안전성 정보
◦ 안전성DB 검색 결과 :
(4) 인체적용시험 시험물질 디자인 대상자 섭취량/ 안전성지표 결과
섭취기간
(5) 섭취량 평가 ◦
(6) 독성시험 ◦ 단회투여 :
* 시험 물질 : ◦ 13주 반복투여 :
◦ 유전독성 (1) 복귀돌연변이 :
(2) 염색체이상시험 :
(3) 소핵시험 :
◦ 기타독성
기타 사항
3. 기능성에 관한 자료
항 목 주요 내용
8. 기능성 시험관시험□ 자료 확보□ 시험 설계 ※ 상세자료 별첨가능
시험물질 실험계 관련지표 결과
※ 추가자료 작성
-
-
동물시험 ※ 상세자료 별첨가능
□ 자료 확보 시험물질 실험동물 섭취량/ 바이오마커 결과
□ 시험 설계 섭취기간
※ 추가자료 작성
-
-
인체적용시험 ※ 상세자료 별첨가능
□ 자료 확보 시험물질 디자인 대상자 섭취량/ 바이오마커 결과
□ 시험 설계 섭취기간
※ 추가자료 작성
-
-
기타 사항
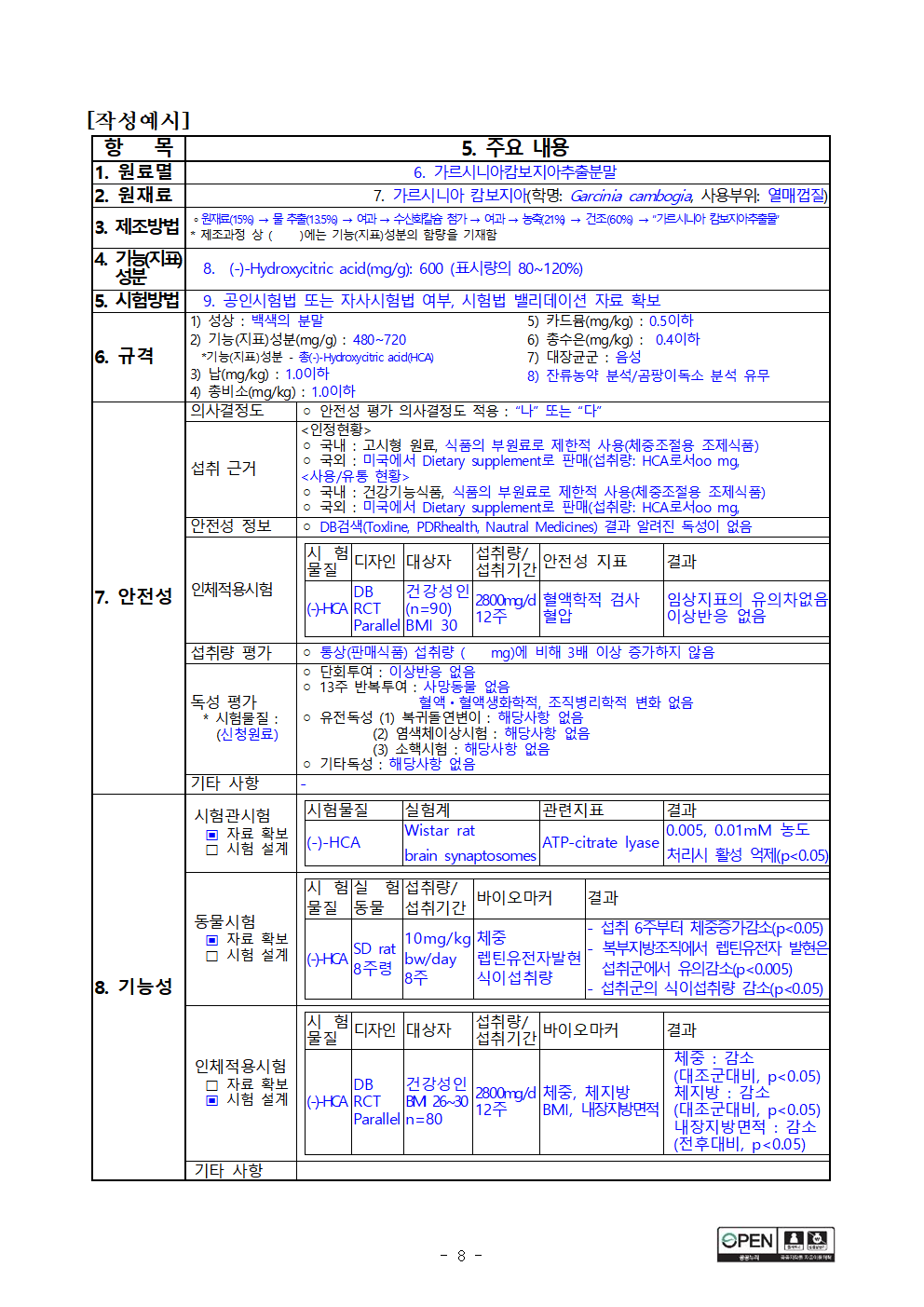
[작성예시]
항 목 주요 내용
1. 원료멸 가르시니아캄보지아추출분말
2. 원재료 가르시니아 캄보지아(학명: Garcinia cambogia, 사용부위: 열매껍질)
3. 제조방법 ∘원재료(15%) → 물 추출(13.5%) → 여과 → 수산화칼슘 첨가 → 여과 → 농축(21%) → 건조(60%) → “가르시니아 캄보지아추출물”
* 제조과정 상 ( )에는 기능(지표)성분의 함량을 기재함
4. 기능(지표) 성분 (-)-Hydroxycitric acid(mg/g): 600 (표시량의 80~120%)
5. 시험방법 공인시험법 또는 자사시험법 여부, 시험법 밸리데이션 자료 확보
6. 규격 1) 성상 : 백색의 분말
2) 기능(지표)성분(mg/g) : 480~720
*기능(지표)성분 - 총(-)-Hydroxycitric acid(HCA)
3) 납(mg/kg) : 1.0이하
4) 총비소(mg/kg) : 1.0이하
5) 카드뮴(mg/kg) : 0.5이하
6) 총수은(mg/kg) : 0.4이하
7) 대장균군 : 음성
8) 잔류농약 분석/곰팡이독소 분석 유무
7. 안전성 의사결정도 ◦ 안전성 평가 의사결정도 적용 : “나” 또는 “다”
섭취 근거 <인정현황>
◦ 국내 : 고시형 원료, 식품의 부원료로 제한적 사용(체중조절용 조제식품)
◦ 국외 : 미국에서 Dietary supplement로 판매(섭취량: HCA로서oo mg,
<사용/유통 현황>
◦ 국내 : 건강기능식품, 식품의 부원료로 제한적 사용(체중조절용 조제식품)
◦ 국외 : 미국에서 Dietary supplement로 판매(섭취량: HCA로서oo mg,
안전성 정보 ◦ DB검색(Toxline, PDRhealth, Nautral Medicines) 결과 알려진 독성이 없음
인체적용시험 시험물질 디자인 대상자 섭취량/ 안전성 지표 결과
섭취기간
(-)-HCA DB 건강성인(n=90) 2800mg/d 혈액학적 검사 임상지표의 유의차없음
RCT BMI 30 12주 혈압 이상반응 없음
Parallel
섭취량 평가 ◦ 통상(판매식품) 섭취량 ( mg)에 비해 3배 이상 증가하지 않음
독성 평가 ◦ 단회투여 : 이상반응 없음
* 시험물질 : (신청원료) ◦ 13주 반복투여 : 사망동물 없음
혈액ㆍ혈액생화학적, 조직병리학적 변화 없음
◦ 유전독성 (1) 복귀돌연변이 : 해당사항 없음
(2) 염색체이상시험 : 해당사항 없음
(3) 소핵시험 : 해당사항 없음
◦ 기타독성 : 해당사항 없음
기타 사항 -
8. 기능성 시험관시험 시험물질 실험계 관련지표 결과
▣ 자료 확보 (-)-HCA Wistar rat ATP-citrate lyase 0.005, 0.01mM 농도
□ 시험 설계 brain synaptosomes 처리시 활성 억제(p<0.05)
동물시험 시험물질 실험 동물 섭취량/ 바이오마커 결과
▣ 자료 확보 섭취기간
□ 시험 설계 (-)-HCA SD rat 10mg/kg bw/day 체중 - 섭취 6주부터 체중증가감소(p<0.05)
8주령 8주 렙틴유전자발현 - 복부지방조직에서 렙틴유전자 발현은 섭취군에서 유의감소(p<0.005)
식이섭취량 - 섭취군의 식이섭취량 감소(p<0.05)
인체적용시험 시험물질 디자인 대상자 섭취량/ 바이오마커 결과
□ 자료 확보 섭취기간
▣ 시험 설계 (-)-HCA DB 건강성인 2800mg/d 체중, 체지방 체중 : 감소
RCT BMI 26~30 12주 BMI, 내장지방면적 (대조군대비, p<0.05)
Parallel n=80 체지방 : 감소
(대조군대비, p<0.05)
내장지방면적 : 감소
(전후대비, p<0.05)
기타 사항
'판교핫뉴스1' 카테고리의 다른 글
| 인삼 등 기능성 원료 8종의 안전기준 강화-「건강기능식품의 기준 및 규격」 일부개정고시안 행정예고 (0) | 2021.06.10 |
|---|---|
| 중소제약기업, '식약처 특허 컨설팅' 신청하세요!-올해 10개 이내 기업 지원 목표 (0) | 2021.06.10 |
| 적합성평가위원회 구성 및 제1차 회의 개최-선별급여 재평가 전담을 위한 적합성평가위원회 신설, 조건부 선별급여 관리 등 심의 (0) | 2021.06.10 |
| (가칭)카카오손해보험㈜ 보험업 예비허가 (0) | 2021.06.10 |
| 온라인투자연계금융업 3개사 최초 등록-㈜에잇퍼센트, ㈜렌딧, ㈜피플펀드컴퍼니, 3개社 (0) | 2021.06.10 |
