단백질 구조변화를 한 편의 영화처럼 촬영-미세유체장치로 시분해 시료 제작, 생화학반응 원자수준에서 규명
등록일 2020.07.23.









단백질 구조변화를 한 편의 영화처럼 촬영
미세유체장치로 시분해 시료 제작, 생화학 반응 원자 수준에서 규명
□ 단백질을 꽁꽁 얼려 찰나에 일어나는 단백질의 구조변화를 한 편의 영화처럼 볼 수 있는 기술이 개발됐다.
○ 단백질은 물질대사, 효소 활성화 작용 등 다양한 생체활동을 주도하는 고분자로 대부분 이들 단백질을 표적으로 약물이 개발되는 경우가 많다. 그런데 이들 단백질의 기능은 주로 3차원 구조에서 비롯되기에 단백질의 구조를 이해하는 것은 의약학 분야의 중요한 화두이다.
□ 한국연구재단(이사장 노정혜)은 이창수 교수(충남대학교 응용화학공학과) 연구팀은 국제공동연구를 통해 초저온투과전자현미경(cryo-TEM)을 이용, 생화학 반응에서 단백질의 3차원 구조변화를 분석할 수 있는 미세유체장치를 개발했다고 밝혔다.
※초저온투과전자현미경(Cryo-EM) : 단백질 같은 생체분자의 3차원 구조를 고해상도로 해석하는 전자현미경, 전자빔에 의한 시료손상을 막기 위해 영하 196℃에서 급냉하여 얇은 비정질 얼음막 내 시료를 보존한다.
○ 단백질 구조변화 관찰에는 2017년 노벨화학상을 수상한 초저온 투과전자현미경이 주로 사용되지만 샘플제작을 위한 소요 시간이 수 십 초 이상 이다. 밀리 초(1000분의 1초, ms) 단위에서 일어나는 생화학반응에서 단백질의 동역학적 거동을 관찰 하기란 불가능했다.
□ 이에 연구팀은 시분해능(time-resolved) 샘플링이 가능한 미세유체장치를 이용하여 반응물로부터 반응중인 시료를 급냉, 반응의 중간체 구조를 얻는 방법을 고안하였다.
○ 미세유체장치 내에서 흐르는 반응물 시료의 유량을 정밀하게 제어, 장치 내 반응물의 체류 시간을 이용하여 생화학 반응 시간을 계산하는 원리를 이용하였다.
□ 기존 장치는 넓은 범위의 시분해능을 얻기 위해 장치 부피를 늘리거나 유량을 줄이는 방식이었다.
○ 이 경우 혼합효율 저하와 유속의 편차로 서로 다른 반응 시간을 갖는 중간체가 공존하게 된다. 때문에 구조를 해석하기 어렵고 동적변화의 순서를 파악하기 어려운 한계가 있었다.
□ 이를 해결하기 위해 연구팀은 레고처럼 손쉽게 조립할 수 있는 모듈화된 구조로 넓은 범위의 시분해능을 확보할 수 있는 장치를 제작하였다.
○ 각기 다른 체류시간을 갖는 미세유체모듈을 분사모듈에 장착하여 20~1,500 밀리 초(ms)의 범위에서 반응시간을 제어할 수 있었다.
□ 실제 이미 구조가 알려진 모델단백질(Apoferritin)을 미세유체장치를 통해 분사하여 초저온투과전자현미경으로 관찰, 원자 수준에 해당하는 2.77Å의 초고해상도 3차원 구조를 확보하였다.
○ 한편 시분해능을 확인하기 위해, 단일가닥 DNA상 사슬화반응이 일어나는 RecA 효소를 통해 검증하였다.
□ 이번 연구성과는 충남대학교 연구팀과 스위스 ETH Zurich 연구진(마티아스 피터 교수, 이성식 박사), 영국 프랜시스크릭연구소(Radoslav Enchev 박사, Märt-Erik Mäeots 연구원)의 긴밀한 국제공동연구를 통해 얻은 결과이다.
○ 과학기술정보통신부와 한국연구재단이 추진하는 기초연구실 (글로벌연구실사업)의 지원으로 수행된 이번 연구의 성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 7월 10일 게재 되었다.
주요내용 설명
<작성자 : 충남대 응용화학공학과 이창수>
키워드
Time-resolved cryo-EM, Microfluidics, Structural Biology, Reaction intermediates
논문명
Modular microfluidics enables kinetic insight from time-resolved cryo-EM
저 널
Nature Communications
저 자
이병진 연구원 (공동 제1저자)/충남대학교), Märt-Erik Mäeots (공동 제1저자)/The Francis Crick Institute/ 이하 동일), Andrea Nans, Mohammad M. N. Esfahni, Shan Ding, 정성근 (공동/ 충남대학교), Daniel J. Smith (공동/ ETH Zurich)), 이창수 교수 (공동 교신저자/충남대학교), 이성식 박사, Matthias Peter 교수 (공동 교신저자/ETH Zurich)), Radoslav Enchev 박사(공동 교신저자/The Francis Crick Institute)
1. 연구의 필요성
○ 효소와 같은 단백질 분자의 활성은 3차원 구조에 기인하며 3차원 구조에 따라 다양한 기질에 특이적 반응성을 가진다. 기질과 결합한 단백질 분자는 3차원적 변형이 일어남으로써 활성을 갖게 된다.
○ 그러나 생체 내 생화학 반응의 속도는 수 십 밀리 초(ms, 1000분의 1초)에서 수 백 밀리 초와 같이 매우 짧은 순간에 일어나기 때문에 생화학 반응 중 단백질의 구조 변화를 관찰하는 것은 매우 어렵다.
○ 현재 단백질의 구조분석 기술 중 각광받는 방법은 2017년 노벨 화학상을 수상한 초저온투과전자현미경분석법(Cryo-EM)이다. 하지만, 실험시간이 수십 초 이상 소요되기 때문에 밀리 초 단위에서 일어나는 단백질의 동역학적 거동을 관찰하기란 불가능하다.
○ 생화학 반응 중 변화하는 단백질의 중간체 구조(intermediate struc ture)를 확보하기 위한 방법이 필요하였다.
○ 이에 반응 중인 단백질을 급속 냉동하여 중간체 구조를 얻는 방법을 고안 하였다. 아이디어를 구현하기 위해 밀리 초 단위의 반응을 제어할 수 있는 미세유체장치를 사용하였고, 반응 중인 단백질 구조를 용이 하게 확보할 수 있었다.
2. 연구내용
○ 단백질의 동역학적 거동을 밀리 초 단위로 관찰할 수 있는 미세유체 장치를 제작하였다. 미세유체장치는 유량을 나노 단위로 정밀하게 제어할 수 있다.
○ 생화학 반응시간은 유체가 장치 내 체류하는 시간이며 이는 부피 유량과 장치 내 부피를 이용하여 손쉽게 제어할 수 있다. 생화학 반응을 ‘한 편의 영화’처럼 촬영하기 위해서는 넓은 영역 대의 시분해능(time-resolution)을 가지는 샘플링 방법이 필요하다.
○ 하지만 장치 내 부피를 늘리거나 유속을 줄이면 혼합 효율이 저하되고, 유속의 편차가 증가하여 반응장치 내부에 서로 다른 반응시간을 가지는 기질-단백질 복합체가 공존하는 문제가 발생할 수 있다. 이러한 문제점을 방지하기 위해 반응기 내 체류시간이 서로 다른 모듈화 된 구조의 미세유체장치를 제작하였다.
○ 장치의 시분해능은 20 밀리 초에서 1,500 밀리 초 범위에서 제어할 수 있었다. 최적화된 장치에서는 Apoferritin 단백질 시료를 사용하여 원자 수준에 해당하는 2.77Å의 초고해상도를 확보할 수 있었다. 이를 바탕으로, 단일 가닥 DNA 상의 RecA 단백질 사슬화 반응을 통해 장치의 시분해능을 입증하였다.
3. 연구성과/기대효과
○ 효소 같은 단백질은 우리 몸 속에서 다양한 대사 조절에 관여하기 때문에 약물로 활용되거나 약물의 주된 표적으로 사용된다. 따라서, 단백질이 생화학 반응 중 나타내는 구조적 변화 메커니즘을 이해하고 해석하는 것은 의약 산업에 많은 정보를 제시할 수 있다. 기존 약물의 구조 메커니즘 해석을 통해 부작용을 줄일 수 있고, 다른 한 편으로는 새로운 적응증(indication)에 활용하는 신약개발도 가능하다.
○ 대표적인 예로 현재까지 세계적인 위협으로 자리잡은 신종코로나 바이러스(SARS-CoV-2)에 대해 초저온전자현미경을 이용하여 구조를 해석하였다. 이를 통해 바이러스 표면의 스파이크 단백질 구조와 세포 내로 침투하는 경로를 밝혀 신속한 의약품 개발에 중요한 단초를 제공하였다.
○ 이처럼 단백질 구조분석은 자연과학 및 의약산업 등 많은 곳에 중요한 정보를 제시할 수 있다. 따라서 본 연구에서 진행한 ‘단백질의 구조 변화 메커니즘’ 분석 기술은 ‘반응 전’과 ‘반응 후’의 단백질 구조 뿐 아니라 ‘반응 중’인 단백질의 구조적 정보까지 알 수 있기 때문에 구조분석에 대한 패러다임 변화를 가져올 수 있을 것이라 전망한다.
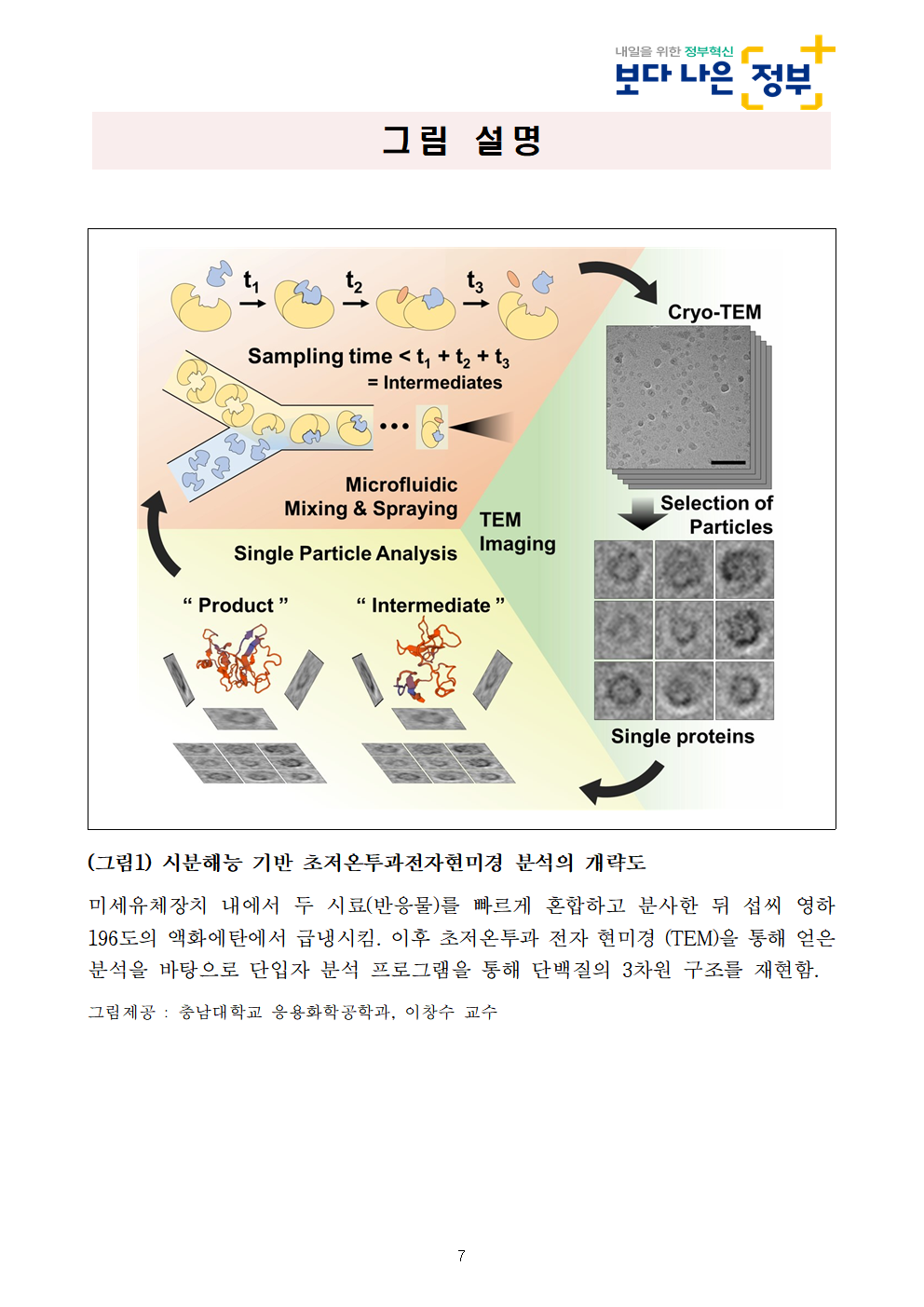
그림 설명
(그림1) 시분해능 기반 초저온투과전자현미경 분석의 개략도
미세유체장치 내에서 두 시료(반응물)를 빠르게 혼합하고 분사한 뒤 섭씨 영하 196도의 액화에탄에서 급냉시킴. 이후 초저온투과 전자 현미경 (TEM)을 통해 얻은 분석을 바탕으로 단입자 분석 프로그램을 통해 단백질의 3차원 구조를 재현함.
그림제공 : 충남대학교 응용화학공학과, 이창수 교수
(그림2) 모델 단백질에 대한 시분해능 기반 초저온투과전자현미경 분석결과
(왼쪽 상단) 세포 내 자가포식(autophagy) 과정을 조절하는 단백질 복합체 (CSN-SCF)의 2차원 분석 이미지
(오른쪽 상단) 미세유체장치의 초저온전자현미경 분석의 적합성을 평가하기 위한 모델 단백질로 Apoferritin을 사용하였으며, 원자수준에 해당하는 (2.77 Å) 초고해상도 3차원 결과를 얻을 수 있었음
(아래) 시간에 따른 재조합 효소(RecA)의 단일가닥 DNA상 사슬화 반응이 진행됨에 따라 RecA 단백질 사슬의 길어지는 것을 통해 시분해능을 보여줌
그림제공 : 충남대학교 응용화학공학과, 이창수 교수
연구 이야기
<작성자 : 충남대 응용화학공학과 이창수>
□ 연구를 시작한 계기나 배경은?
2014년 경부터 스위스 ETH Zurich 생화학과 연구팀과 공동연구를 수행하였습니다. 공동 교신 저자로 참여한 라도 박사(Dr. Radoslav Enchev)가 당시 박사후연구원으로 재직 중이었는데, 세미나 발표를 우연히 듣게 되었습니다. 라도 박사는 단백질의 생화학 반응을 구조분석을 통해 접근하는 연구를 수행하고 있었습니다. 단백질의 중간체 구조를 알아야 문제를 풀 수 있는데, 당시에 연구실에 있던 장치로는 아무리 빨라도 시료를 제작하는데 수 초 이상의 시간이 소요되었 습니다. 이에 미세유체장치를 이용한 시분해능 샘플링 방법을 제안하였습니다.
□ 연구 전개 과정에 대한 소개
어떤 방법으로 샘플 시료를 분사하여 TEM 분석용 그리드에 올릴 것 인지에 대한 고민이 많았습니다. 초기에 전기분무 (electrospray) 방법을 이용하고자 했었는데, 단백질의 구조의 변성이 생기거나 그리드가 하전되며 분사된 샘플이 그리드에 제대로 올라가지 못하는 것을 확인하였습니다. 이후에는 고압가스를 이용한 분사 방법을 채택하였습니다.
미세유체장치의 개발과 최적화는 우리 연구실에서 단독으로 진행할 수 있었기에 진행이 빠르게 되었으나, 초저온투과전자현미경은 매우 고가의 장비로 당시에 국내에는 한 대 밖에 운용되고 있지 않았던 상황이었기 때문에 구조분석 실험을 진행하는 것에 상당한 어려움이 있었습니다. 이병진 박사과정 학생이 방학 기간을 이용하여 스위스에서 파견연구를 수행하며 실험을 진행하였습니다.
□ 연구하면서 어려웠던 점이나 장애요소는 무엇인지? 어떻게 극복(해결)하였는지?
연구의 수행과정에서 소통에 어려움이 있었습니다. 공학자와 과학자의 기본적인 관점 차이로 인해 의견차이가 자주 발생했었습니다. 공동 교신저자로 참여한 ETH Zurich의 이성식 박사 (Dr. Sung Sik Lee)가 의견 조율에 애써주어 원활하게 연구가 진행될 수 있었습니다.
□ 이번 성과, 무엇이 다른가?
모듈화된 구조 장치를 이용해 1000ms 이상의 넓은 범위의 시분해능을 확보하였습니다. 각기 다른 반응시간을 갖는 장치를 설계하고 실리콘 고분자(PDMS, Polydimethylsiloxane)를 이용해 복제가 용이하게 하였습니다. 이를 스프레이 노즐과 결합하여 손쉽게 원하는 생화학 반응의 반응시간을 제어할 수 있습니다.
□ 실용화된다면 어떻게 활용될 수 있나? 실용화를 위한 과제는?
생화학 반응을 구조적으로 해석해내는 것은 약리학 및 의약학 연구에서 중요성이 매우 큽니다. 그럼에도 현재까지 구조적인 메커니즘이 명확히 규명된 생화학 반응은 매우 적습니다. 단백질의 생화학 반응 중 나타니는 구조적 변화 메커니즘을 이해하고 해석하는 것은 의약 산업에 도움이 될 수 있습니다. 기존 약물의 메커니즘 분석을 통해 부작용을 줄일 수 있고, 현재 개발된 약물을 다른 용도(새로운 적응증)로 활용하는 신약개발연구도 가능합니다.
□ 꼭 이루고 싶은 목표나 후속 연구계획은?
코로나바이러스 글로벌 펜데믹과 관련하여 구조생물학자들의 역할이 매우 컸습니다. 바이러스가 세포 내로 침투하는 구조적 경로를 분석하여 약물 개발 시나리오의 단초를 제공하였습니다. 이번 사태로 인해 우리나라 생명과학 분야의 우수성이 전 세계에 알려졌습니다. 기회를 발판삼아 우리나라의 생명과학 연구가 구조생물학과 같은 기초연구부분에서도 선도하는데 힘을 보태고 싶습니다.
