'리팜피신' 함유 의약품 안전성 조사 결과 발표
담당부서 | 의약품관리과 등 2021-01-21








‘리팜피신’ 함유 의약품 안전성 조사 결과 발표
▪ 국내 유통제품 MNP 1.68~6.07ppm 검출…환자 건강 큰 영향은 없어
▪ 원료 중 MNP 함량 낮추기 위해 2단계 불순물 저감화 조치 시행
□ 식품의약품안전처(처장 김강립)는 결핵 치료제 ‘리팜피신’1) 함유 의약품에 대해 수거·검사한 결과, 니트로사민 계열 불순물(MNP2))이 검출됨(1.68~6.07ppm)에 따라 원료 중 MNP 함량을 낮추기 위한 불순물 저감화 조치를 시행합니다.
1) 리팜피신 : 결핵 1차 치료제로 사용되는 국가필수의약품으로 현재 생산‧유통되는 제품은 완제의약품 9품목(3개사), 원료의약품 1품목(1개사)이 있음
2) MNP(1-메틸-4-니트로소피페라진) : 니트로사민 계열(NDMA* 등)의 화합물로 발암가능성 평가 자료가 존재하지 않아 중앙약사심의위원회 자문을 통해 이미 알려진 NDMA 평가 자료를 적용하여 잠정관리기준 설정
* NDMA(N-니트로소디메틸아민) : WHO 국제 암연구소(IARC)가 지정한 인체 발암 추정물질로 고혈압약 등에서 검출된 바 있는 비의도적 불순물
○ 식약처는 지난해 미국에서 리팜피신(미국명: 리팜핀) 함유 의약품 중 일부에서 니트로사민 계열 불순물(MNP)이 잠정관리기준*(0.16ppm)을 초과해 검출됨에 따라 국내 제품의 안전성을 확인하기 위해 지난해 9월부터 수거·검사에 착수한 바 있습니다.
* 잠정관리기준 : 사람이 매일 의약품 1일 최대 복용량을 평생(70년) 복용할 때 자연발생적인 발암가능성에 더하여 10만분의 1의 확률로 암이 더 발생할 수 있는 니트로사민 계열 불순물의 1일 최대 섭취 허용량을 의미
※ 2020.9.25.(금) 보도자료 참조
❮ ① 의약품 수거‧검사 결과 ❯
□ 식약처 수거·검사 결과, 국내 유통 중인 모든 ‘리팜피신’ 함유 의약품에서 MNP가 잠정관리기준(0.16ppm)을 초과해 검출됐고 완제의약품에서의 MNP 함량은 1.68ppm ~ 6.07ppm으로 나타났습니다.
○ 이 검출 결과는 결핵 치료에 필수적인 의약품의 공급 부족을 방지하고 환자 접근성을 고려해 ‘유통 허용한도’*를 설정한 미국의 기준(5ppm)과 유사한 수준입니다.
* 기준 이하 제품에 대해 한시적으로 유통을 허용
- 참고로 유럽·WHO 등에서도 리팜피신 함유 의약품에서 MNP가 검출돼 조사를 진행하고 있습니다.
❮ ② 복용환자에 대한 영향 ❯
□ 잠정관리기준을 초과한 ‘리팜피신’ 함유 의약품이 대다수 환자에게 건강상 미치는 큰 영향은 없을 것으로 판단됩니다.
○ ‘리팜피신’ 복용 환자에 대한 인체영향평가는 해당 의약품의 일일 최대 복용량(600mg)을 일반적인 복용기간(1년 이하) 동안 복용한 상황을 가정하여 수행했으며
- 그 결과 일반적인 상황에 더해 추가적으로 암이 발생할 가능성은 ‘10만명 중 0.29명’으로 매우 낮은 수준인 것으로 확인되었습니다.
* 의약품 분야 국제 가이드라인[ICH M7(International Council for Harmonisation Mutagenic 7)]에 따라 추가 암 발생 가능성이 10만명 중 1명 이하인 경우 무시 가능
○ 아울러 식약처는 건강보험심사평가원의 처방 자료를 기반으로 실제 의약품 복용실태를 반영한 인체영향평가를 올해 실시해 복용환자의 건강에 미치는 영향을 추가로 평가할 계획입니다.
❮ ③ 전문가 및 환자에게 드리는 안내 사항 ❯
□ 식약처는 ➊‘리팜피신’이 생명을 위협할 수 있는 결핵 치료에 필수적인 의약품으로서 대체 의약품이 없다는 점 ➋인체영향평가 결과 건강에 대한 영향이 크지 않다는 점 ➌MNP 검출에 대해 전 세계적으로 유사하게 조치*한 상황이라는 점을 고려하고
* 미국 등 주요 국가에서 회수 등의 조치 없이 유통을 허용
○ 중앙약사심의위원회의 자문 결과 등을 종합적으로 검토해 MNP 함량이 잠정관리기준(0.16 ppm)을 초과한 ‘리팜피신’ 중 2.1ppm 이하인 제품에 대한 제조·판매를 한시적으로 허용하기로 결정했습니다.
□ 식약처는 의료기관에 기존 처방 가이드라인 등에 따라 ‘리팜피신’ 함유 의약품의 처방을 계속할 것을 권고했으며
○ 복용환자에게는 건강에 우려가 있더라도 임의로 복용을 중단하지 말고 의약품을 처방한 의료진과 반드시 상의할 것을 당부했습니다.
○ 참고로 미국 FDA 등 각국 규제기관 또한 ‘리팜피신’ 함유 의약품의 사용을 중지하는 것은 MNP 섭취로 인한 잠재적인 위험성을 감수하는 것보다 환자에게 더 큰 위험을 초래하므로, 환자의 질병 치료를 위해 의약품을 지속 복용해야 한다고 발표했습니다.
❮ ④ 불순물(MNP) 2단계 저감화 계획 ❯
□ 식약처는 ‘리팜피신’ 원료 중 MNP 함량을 잠정관리기준 이하로 낮추기 위해 관련 업계와 소통 창구를 개설하는 등 협력체계를 구축했습니다.
○ 다만 원료의약품 제조 시 새로운 공정을 도입해야 하는 데 다소 시간이 소요될 것으로 판단돼 2단계로 저감화하는 방안을 마련했습니다.
○ 우선 1단계로 MNP 함량이 2.1ppm 이하인 완제의약품만을 출하하도록 할 계획으로 제조업체로부터 MNP 시험검사 결과를 제출받아 기준 이하인 경우에만 시중 유통하도록 허용했으며
- 이는 일반적인 복용기간(1년 이하)과 하루 최대 복용량(600mg)을 고려해 국제 가이드라인(ICH M7)에 따라 계산한 값으로 중앙약사심의위원회 자문을 거쳐 정했습니다.
○ 다음으로 좀 더 높은 수준의 원료의약품 제조공정 개선이 필요한 2단계 저감화(0.16ppm) 목표도 최대한 신속하게 달성하기 위해 업계와 지속적으로 논의하고 있습니다.
□ 식약처는 안전하고 효과 있는 우수한 품질의 의약품을 공급하기 위해 각국 규제기관과 현황 정보를 공유하는 등 긴밀히 협력하고 업계와 지속적으로 소통하며
○ 주요 결과가 나오는 대로 조치사항에 대해 국민께 알려드리겠습니다.
<붙임> 1. ‘리팜피신’ 함유 의약품 수거·검사 결과
2. 국내 유통 중인 ‘리팜피신’ 함유 의약품 현황
3. ‘리팜피신’ 관련 Q&A
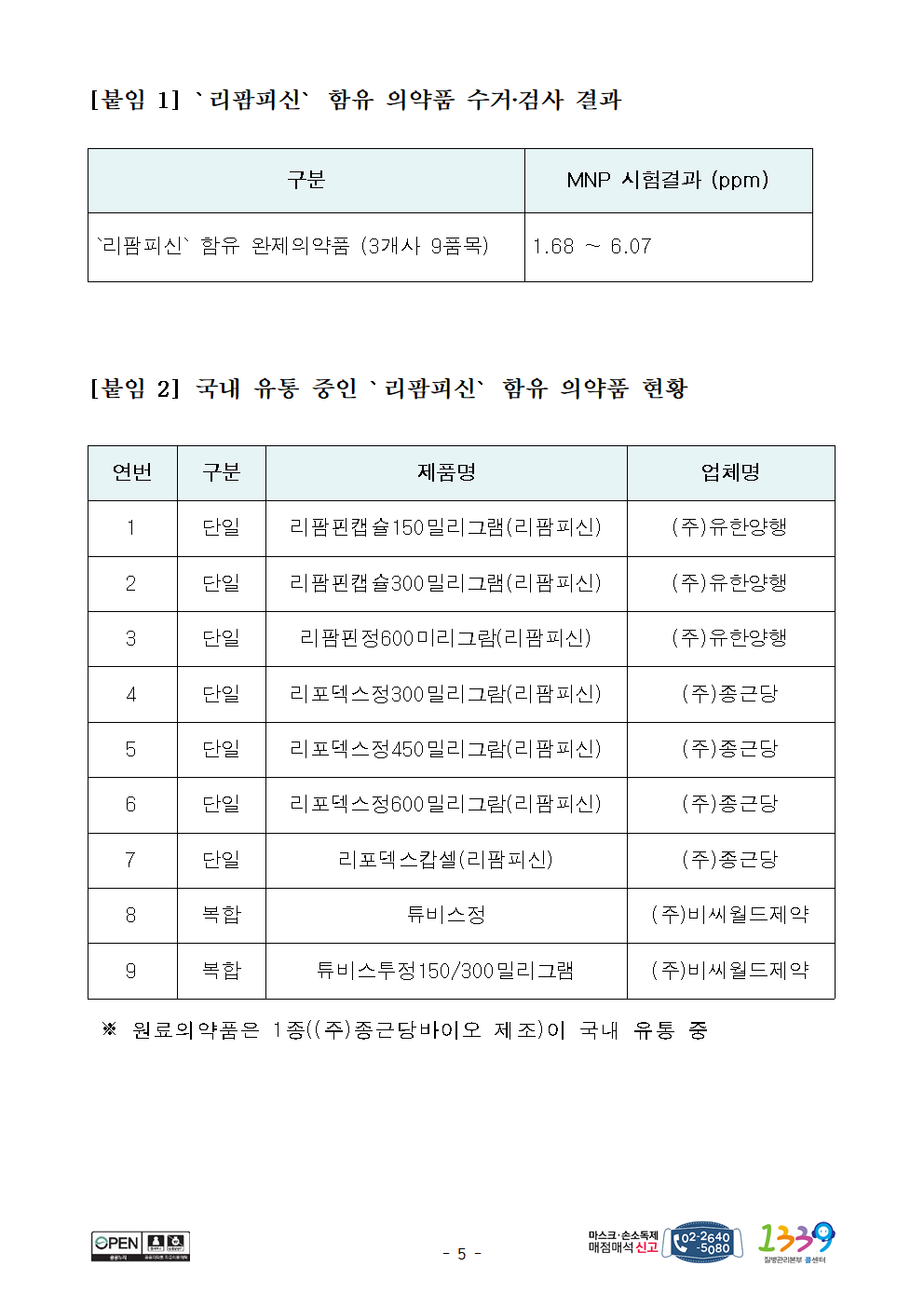
[붙임 1] `리팜피신` 함유 의약품 수거‧검사 결과
구분 MNP 시험결과 (ppm)
`리팜피신` 함유 완제의약품 (3개사 9품목) 1.68 ~ 6.07
[붙임 2] 국내 유통 중인 `리팜피신` 함유 의약품 현황
연번 구분 제품명 업체명
1 단일 리팜핀캡슐150밀리그램(리팜피신) (주)유한양행
2 단일 리팜핀캡슐300밀리그램(리팜피신) (주)유한양행
3 단일 리팜핀정600미리그람(리팜피신) (주)유한양행
4 단일 리포덱스정300밀리그람(리팜피신) (주)종근당
5 단일 리포덱스정450밀리그람(리팜피신) (주)종근당
6 단일 리포덱스정600밀리그람(리팜피신) (주)종근당
7 단일 리포덱스캅셀(리팜피신) (주)종근당
8 복합 튜비스정 (주)비씨월드제약
9 복합 튜비스투정150/300밀리그램 (주)비씨월드제약
※ 원료의약품은 1종((주)종근당바이오 제조)이 국내 유통 중
[붙임 3]
리팜피신 관련 Q&A
Q1) 리팜피신은 무엇인가?
◦ 리팜피신은 대표적인 항결핵균제로 이소니아지드와 함께 핵심 결핵치료 약물로 사용하는 성분입니다.
Q2) 국내 결핵환자 현황은?
◦ 우리나라는 OECD 가입국 중 2018년 결핵발생률 1위, 결핵사망률 2위를 기록하였고, 2019년 보고된 국내 결핵환자 수는 30,304명입니다.
Q3) 리팜피신은 결핵 치료에 반드시 필요한 의약품인가요?
◦ 리팜피신은 결핵 1차 치료 처방에 필수적으로 사용되는 약물로, 대체 의약품이 없습니다.
Q4) 리팜피신을 처방하는 질환별 치료기간은?
◦ 일반적인 복용기간은 1년 이하입니다.
폐결핵 결핵성 흉막염 등 골 및 관절 결핵 결핵성 수막염
6 ~ 9 개월 6 개월 6 ~ 9개월 12개월
Q5) 리팜피신 원료의약품 품목 현황은?
◦ 리팜피신 원료의약품은 3종(제조소 기준)이 등록되어 있으며, 그 중 1종의 원료((주)종근당바이오 제조)가 유통 중에 있습니다.
Q6) 리팜피신 함유 완제의약품 품목 현황은?
◦ 허가된 리팜피신 함유 완제의약품은 4개사 11품목입니다.
- 실제 유통 중인 리팜피신 함유 완제의약품은 3개사 9품목이며, 모두 전문의약품입니다.
* 리팜피신 함유 완제의약품(9품목)의 ‘19년 생산실적은 약 59억원임
Q7) `리팜피신` 함유 의약품 중 MNP[1-methyl-4-nitrosopiperazine(1-메틸-4-니트로소피페라진)] 잠정관리기준(0.16ppm) 설정 근거는?
◦ 니트로사민 계열의 화합물로 발암가능성 평가 자료가 존재하지 않아 구조가 유사한 동일한 니트로사민 계열인 NDMA* 평가자료를 적용하여 잠정관리기준을 설정하였습니다.
* NDMA(N-니트로소디메틸아민) : WHO 국제 암연구소(IARC)가 지정한 인체 발암 추정물질로 고혈압약 등에서 이미 검출된 비의도적 불순물
Q8) `리팜피신` 함유 의약품에서 MNP가 검출된 원인은?
◦ 우리나라를 포함하여 미국, 유럽 등 각 국 규제기관에서 MNP의 생성원인에 대해 조사하고 있습니다.
◦ 현재로서는 ‘리팜피신’ 원료의약품의 합성 과정에서 사용되는 AMP (1-아미노-4-메틸피페라진)에 포함되어 있는 MNP가 충분하게 제거되지 않아 원료의약품과 완제의약품에 잔류하고,
- AMP의 정상 보관 조건에서도 MNP가 일부 생성되는 것으로 알려져 있습니다.
Q9) 각 국 규제기관의 `리팜피신` 함유 의약품에 대한 조치 동향은?
◦ 미국, 유럽 등 주요 국가의 발표 등에 따르면 MNP 검출은 전 세계적으로 유사한 상황인 것으로 판단하고 있으며,
- 각 국 규제기관은 `리팜피신`이 생명을 위협할 수 있는 결핵치료에 필수적인 의약품이고 대체 의약품이 없는 점을 고려하여, 리팜피신 함유 의약품의 사용을 중지하는 것은 MNP 섭취로 인한 잠재적인 위험성을 감수하는 것보다 환자에게 더 큰 위험을 초래하므로, 환자의 질병 치료를 위하여 리팜피신 함유 의약품을 지속 복용해야한다는 점을 강조하고 있습니다.
- 참고로, 미국 등 주요 국가에서 회수 등의 조치 없이 MNP가 검출된 `리팜피신` 함유 의약품의 유통을 허용하고 있습니다.
Q10) MNP 잠정관리기준을 초과 함유한 리팜피신을 지속 복용하여도 되나요?
◦ 결핵 환자에게 있어 리팜피신의 복용 중단으로 인한 위험성이 MNP가 함유된 리팜피신을 복용했을 때의 위험성을 크게 상회하므로 결핵 환자는 리팜피신 의약품을 지속 복용하여야 합니다.
◦ 참고로, MNP 검출 리팜피신을 일반적인 치료기간(1년)동안 복용한 상황을 가정한 인체영향평가 결과, 추가로 암이 발생할 가능성은 10만명 중 0.29명으로 매우 낮은 수준인 것으로 확인되었습니다.
* 의약품 분야 국제 가이드라인(ICH M7)에 따라, 추가 암 발생 가능성이 10만명 중 1명 이하인 경우 무시 가능
◦ 또한, 식약처는 환자의 실제 의약품 복용실태를 반영한 인체영향평가를 실시하여, 잠정관리기준을 초과한 리팜피신을 복용한 환자의 건강에 미치는 영향을 검토할 계획입니다.
Q11) `리팜피신` 원료의약품 중 MNP 2단계 저감화 방안이란?
◦ (1단계 저감화) ‘리팜피신’ 중 MNP 함량을 잠정관리기준(0.16ppm)으로 저감화하기 전까지의 임시 조치로 한시적 잠정관리기준(2.1ppm*)을 설정하였으며, 새로 제조하는 `리팜피신` 함유 의약품은 MNP가 2.1ppm 이하인 경우에만 판매(식약처 사전 승인)하도록 조치하였습니다.
* `리팜피신` 함유 의약품의 일반적인 복용기간(1년 이하)과 일일 최대 복용량(600mg)을 고려하여 ICH M7을 적용한 값으로 중앙약사심의위원회 자문을 통해 확정
◦ (2단계 저감화) 원료의약품 제조과정에서 단순 정제공정을 추가하는 1단계 저감화와는 달리, 좀 더 높은 수준의 원료의약품 제조공정 개선을 통해 잠정관리기준(0.16ppm)이하로 저감화 예정입니다.
Q12) 재발 방지대책은?
◦ 식약처는 미국, 유럽 등 주요 국가와 동일한 수준으로, 제약업체에서 자체적으로 의약품에 비의도적으로 혼입될 수 있는 NDMA 등 불순물에 대한 발생 가능성을 평가하고 시험검사를 실시하도록 조치한 바 있습니다.
- 또한, 식약처에서도 예상치 못하게 불순물이 검출될 수 있는 성분을 조사·연구하여 해당 성분을 사용한 원료 및 완제의약품을 수거·검사하는 등 사전예방 조치를 실시하고 있습니다.
'판교핫뉴스1' 카테고리의 다른 글
| 2021 인공지능 바우처 지원 사업 공모 실시-560억 예산으로 기업 당 최대 3억원 바우처 지원 사업 본격 착수 (0) | 2021.01.21 |
|---|---|
| 수출기업 규제애로 총력지원,“무역기술장벽(TBT) 종합지원센터”출범 (0) | 2021.01.21 |
| 여성건강제품 온라인 허위.과대광고 169건 적발-생리대, 질세정기, 여성청결제 등 구매 시‘질병 예방‧완화’등 광고 주의 (0) | 2021.01.21 |
| 오.남용 동물용의약품 168종 검사...한 번에 가능-동물용의약품 동시 다성분 분석법 마련… 축산물 안전관리에 활용 (0) | 2021.01.21 |
| 국내 개발 코로나19 백신(1.2상) 임상 계획 승인[2021-01-21]-코로나19 백신·치료제 22개 제품 국내 임상시험 진행 (0) | 2021.01.21 |
