2020년「생산·수입·공급 중단 보고대상 의약품」2,989품목 공고
의약품관리종합정보센터 의약품정보관리부 2020-11-30

2020년「생산․수입․공급 중단 보고대상 의약품」2,989품목 공고
-공급 중단 시 중단일의 60일 전까지 식약처에 보고해야 -
□ 건강보험심사평가원(원장 김선민, 이하 ‘심사평가원’)은 2020년도 「생산·수입·공급 중단 보고대상 의약품」을 지난 25일 심사평가원 누리집(http://www.hira.or.kr)과 의약품관리종합정보센터 누리집(https://biz.kpis.or.kr)에 공고했다.
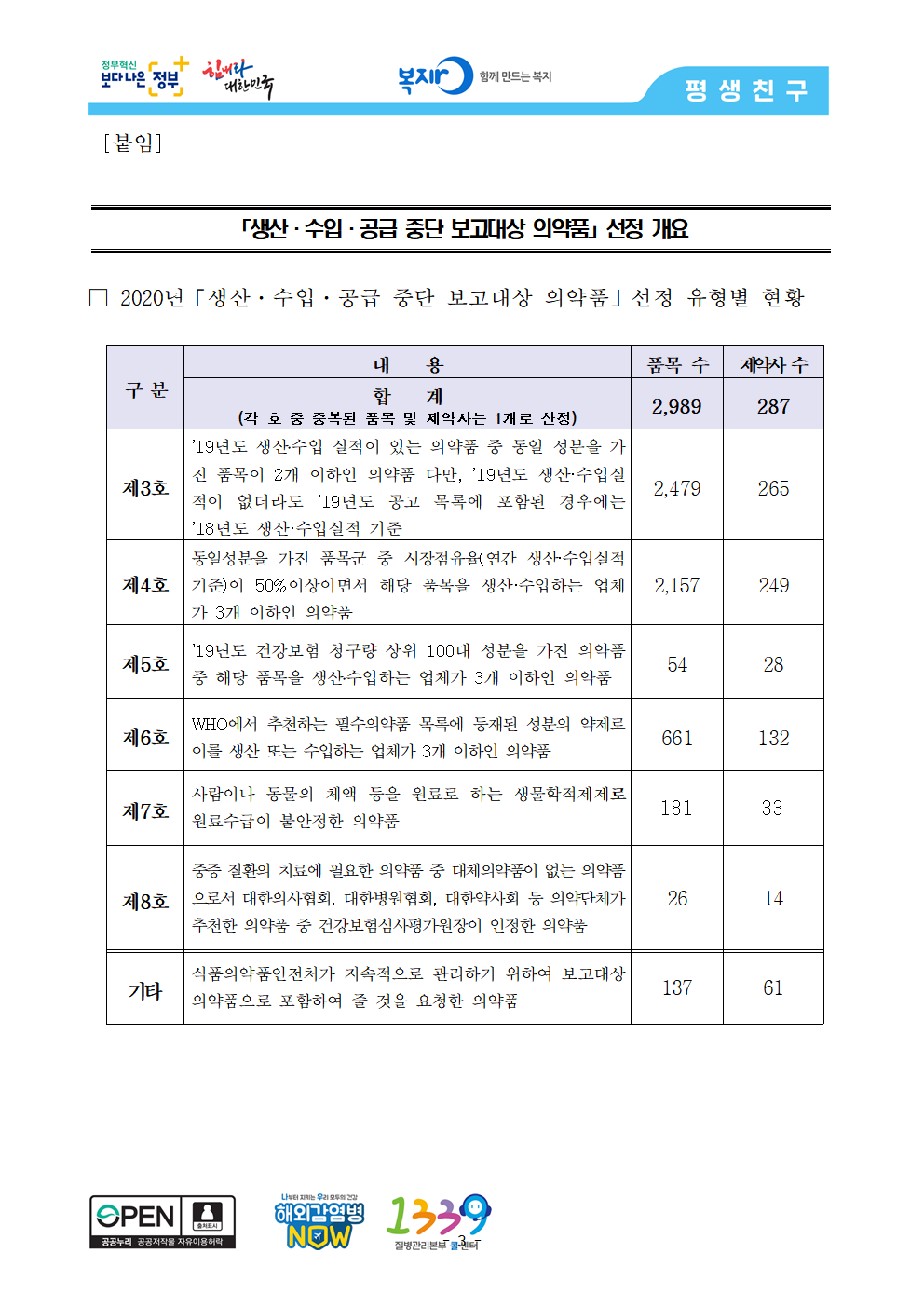
○ 2020년 ‘생산·수입·공급 중단 보고대상 의약품’은 총 2,989품목(287개 제약사)이며, 이 중 ‘동일성분 의약품이 2개 이하인 의약품’이 2,479품목*(265개 제약사)으로 가장 많았다.
* [붙임] 2020년 「생산·수입·공급 중단 보고대상 의약품」 선정 유형별 현황 참고
□ 심사평가원은 ‘생산·수입·공급 중단 보고대상 의약품’ 8가지 유형** 중 퇴장방지의약품과 희귀의약품을 제외한 6가지 유형을 전년도 생산·수입실적과 건강보험 청구량, 의약단체, 업계 의견 등을 반영해 매년 대상의약품을 선정하며, 최종 보건복지부장관 승인을 받아 공고한다.
** [붙임] 「생산·수입·공급 중단 보고대상 의약품 고시」참고
○ 공고된 생산·수입·공급 중단 보고대상 의약품은 중단일의 60일 전까지 그 사유를 식품의약품안전처장에게 보고265개 제약사해야 하며, 이를 준수하지 않을 경우 제조·수입사는 업무정지 행정처분을 받게 된다.
*** [붙임] 「의약품등의 안전에 관한 규칙」참고
□ 김철수 의약품관리종합정보센터장은 “해당 의약품 공고로 의약품의 공급부족을 사전에 예방하고 원활한 수급 관리를 유도하여 국민보건 향상에 기여하고 있다”며, “동 제도가 원활히 운영될 수 있도록 해당 의약품을 생산·수입하는 제약사 및 관련 단체의 적극적인 협조를 바란다”고 전했다.
[붙임] 「생산·수입·공급 중단 보고대상 의약품」선정 개요
[붙임]
「생산·수입·공급 중단 보고대상 의약품」선정 개요
□ 2020년「생산·수입·공급 중단 보고대상 의약품」선정 유형별 현황
구 분 내 용 품목 수 제약사 수
합 계 2,989 287
(각 호 중 중복된 품목 및 제약사는 1개로 산정)
제3호 ’19년도 생산․수입 실적이 있는 의약품 중 동일 성분을 가진 품목이 2개 이하인 의약품 다만, ’19년도 생산·수입실적이 없더라도 ’19년도 공고 목록에 포함된 경우에는 ’18년도 생산·수입실적 기준 2,479 265
제4호 동일성분을 가진 품목군 중 시장점유율(연간 생산·수입실적 기준)이 50%이상이면서 해당 품목을 생산·수입하는 업체가 3개 이하인 의약품 2,157 249
제5호 ’19년도 건강보험 청구량 상위 100대 성분을 가진 의약품 중 해당 품목을 생산․수입하는 업체가 3개 이하인 의약품 54 28
제6호 WHO에서 추천하는 필수의약품 목록에 등재된 성분의 약제로 이를 생산 또는 수입하는 업체가 3개 이하인 의약품 661 132
제7호 사람이나 동물의 체액 등을 원료로 하는 생물학적제제로 원료수급이 불안정한 의약품 181 33
제8호 중증 질환의 치료에 필요한 의약품 중 대체의약품이 없는 의약품으로서 대한의사협회, 대한병원협회, 대한약사회 등 의약단체가 추천한 의약품 중 건강보험심사평가원장이 인정한 의약품 26 14
기타 식품의약품안전처가 지속적으로 관리하기 위하여 보고대상 의약품으로 포함하여 줄 것을 요청한 의약품 137 61
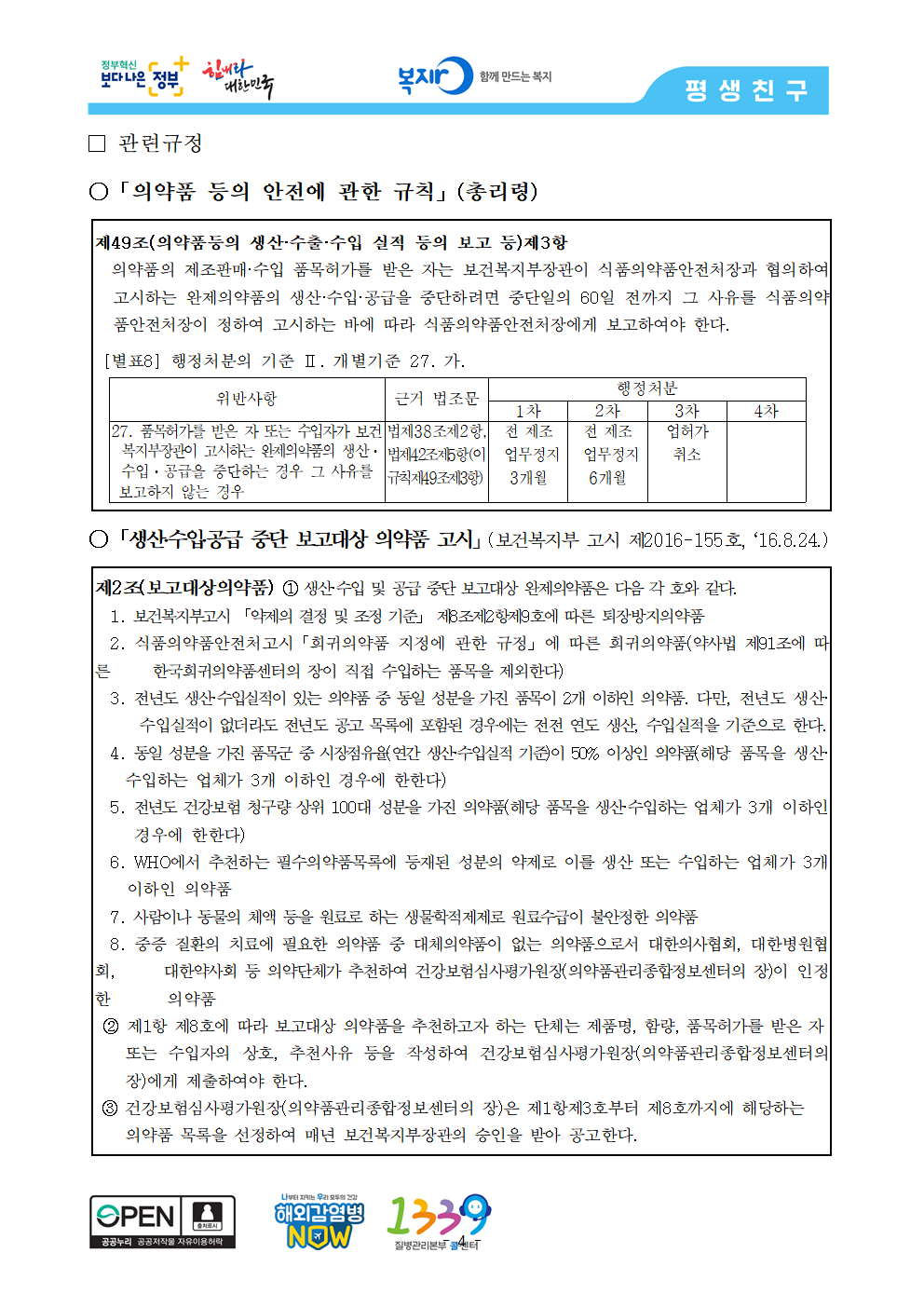
□ 관련규정
○「의약품 등의 안전에 관한 규칙」(총리령)
제49조(의약품등의 생산·수출·수입 실적 등의 보고 등)제3항
의약품의 제조판매·수입 품목허가를 받은 자는 보건복지부장관이 식품의약품안전처장과 협의하여 고시하는 완제의약품의 생산·수입·공급을 중단하려면 중단일의 60일 전까지 그 사유를 식품의약품안전처장이 정하여 고시하는 바에 따라 식품의약품안전처장에게 보고하여야 한다.
[별표8] 행정처분의 기준 Ⅱ. 개별기준 27. 가.
위반사항 근거 법조문 행정처분
1차 2차 3차 4차
27. 품목허가를 받은 자 또는 수입자가 보건복지부장관이 고시하는 완제의약품의 생산ㆍ수입ㆍ공급을 중단하는 경우 그 사유를 법제38조제2항, 법제42조제5항(이 규칙제49조제3항) 전 제조 전 제조 업허가
보고하지 않는 경우 업무정지 업무정지 취소
3개월 6개월
○「생산․수입․공급 중단 보고대상 의약품 고시」(보건복지부 고시 제2016-155호, ‘16.8.24.)
제2조(보고대상의약품) ① 생산·수입 및 공급 중단 보고대상 완제의약품은 다음 각 호와 같다.
1. 보건복지부고시 「약제의 결정 및 조정 기준」 제8조제2항제9호에 따른 퇴장방지의약품
2. 식품의약품안전처고시「희귀의약품 지정에 관한 규정」에 따른 희귀의약품(약사법 제91조에 따른 한국희귀의약품센터의 장이 직접 수입하는 품목을 제외한다)
3. 전년도 생산·수입실적이 있는 의약품 중 동일 성분을 가진 품목이 2개 이하인 의약품. 다만, 전년도 생산· 수입실적이 없더라도 전년도 공고 목록에 포함된 경우에는 전전 연도 생산, 수입실적을 기준으로 한다.
4. 동일 성분을 가진 품목군 중 시장점유율(연간 생산·수입실적 기준)이 50% 이상인 의약품(해당 품목을 생산· 수입하는 업체가 3개 이하인 경우에 한한다)
5. 전년도 건강보험 청구량 상위 100대 성분을 가진 의약품(해당 품목을 생산·수입하는 업체가 3개 이하인 경우에 한한다)
6. WHO에서 추천하는 필수의약품목록에 등재된 성분의 약제로 이를 생산 또는 수입하는 업체가 3개 이하인 의약품
7. 사람이나 동물의 체액 등을 원료로 하는 생물학적제제로 원료수급이 불안정한 의약품
8. 중증 질환의 치료에 필요한 의약품 중 대체의약품이 없는 의약품으로서 대한의사협회, 대한병원협회, 대한약사회 등 의약단체가 추천하여 건강보험심사평가원장(의약품관리종합정보센터의 장)이 인정한 의약품
② 제1항 제8호에 따라 보고대상 의약품을 추천하고자 하는 단체는 제품명, 함량, 품목허가를 받은 자
또는 수입자의 상호, 추천사유 등을 작성하여 건강보험심사평가원장(의약품관리종합정보센터의 장)에게 제출하여야 한다.
③ 건강보험심사평가원장(의약품관리종합정보센터의 장)은 제1항제3호부터 제8호까지에 해당하는
의약품 목록을 선정하여 매년 보건복지부장관의 승인을 받아 공고한다.
'판교핫뉴스1' 카테고리의 다른 글
| [제47주차 IR52 장영실상] GS칼텍스 / 친환경 2,3-부탄다이올 (0) | 2020.12.01 |
|---|---|
| 청년특별구직지원금 추가신청 접수!-현재 15.3만명 지급 완료, 지원자격을 확대하여 추가로 4.7만명 지원 (0) | 2020.12.01 |
| 치약.구중청량제 제품 정보 확인이 보다 쉬워집니다 (0) | 2020.12.01 |
| 햄, 베이컨 제품 해썹(HACCP) 관리 강화 된다!-「축산물 위생관리법 시행규칙」개정 (0) | 2020.12.01 |
| 유치원 등 집단급식소 과태료 부과기준 상향 조정 (0) | 2020.12.01 |
